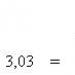Productos de reacción de combustión. Tipos de reacciones químicas
Tema 3. BASES QUÍMICAS DE LA COMBUSTIÓN.
3.1. Química de las reacciones de combustión.
Como ya has entendido, la combustión es una reacción química rápida acompañada de la liberación de calor y resplandor (llama). Por lo general, esta es una reacción oxidativa exotérmica de la combinación de una sustancia combustible con un agente oxidante: el oxígeno atmosférico.
sustancias combustibles pueden ser gases, y liquidos, y solidos-la. Estos son H 2, CO, azufre, fósforo, metales, C m H n (hidrocarburos en forma de gases, líquidos y sólidos, es decir, sustancias orgánicas. Los hidrocarburos naturales, por ejemplo, son gas natural, petróleo, carbón). En principio, todas las sustancias susceptibles de oxidación pueden ser combustibles.
Oxidantes servir: oxígeno, ozono, halógenos (F, Cl, Br, J), óxido nitroso (NO 2), nitrato de amonio (NH 4 NO 3), etc. En metales, CO 2, H 2 O, N 2 también pueden ser agentes oxidantes.
En algunos casos, la combustión se produce durante reacciones de descomposición de sustancias obtenidas en procesos endotérmicos. Por ejemplo, cuando el acetileno se descompone:
C 2 H 2 \u003d 2C + H 2.
exotérmico Las reacciones son reacciones que liberan calor.
endotérmico Las reacciones son reacciones que tienen lugar con la absorción de calor.
Por ejemplo:
2H 2 + O 2 \u003d 2H 2 O + Q - reacción exotérmica,
2H 2 O + Q \u003d 2H 2 + O 2 - reacción endotérmica,
donde: Q - energía térmica.
Por lo tanto, las reacciones endotérmicas solo pueden proceder con la introducción de energía térmica externa, es decir, cuando se calienta.
En las reacciones químicas, según la ley de conservación de la masa, el peso de las sustancias antes de la reacción es igual al peso de las sustancias formadas después de la reacción. Al igualar las ecuaciones químicas, obtenemos estequiométrico formulaciones.
Por ejemplo, en la reacción
CH 4 + 2O 2 \u003d CO 2 + 2H 2 O
tenemos 1 mol CH 4 + 2 mol O 2 = 1 mol CO 2 + 2 mol H 2 O.
El número de moles delante de las fórmulas de las sustancias se llama coeficientes estequiométricos.
Teniendo en cuenta los conceptos de "volumen molar", "concentración molar", "presión parcial", encontramos que para una reacción completa de metano, 1 mol de CH 4 debe mezclarse con 2 moles de O 2, o 1/3 \u003d 33,3% CH 4 y 2 / 3=66,7% O 2 . Tal composición se llama estequiométrica.
Si consideramos la combustión de CH 4 en el aire, es decir, en una mezcla de 21% O 2 + 79% N 2 o O 2 + 79 / 21N 2 o O 2 + 3.76N 2, entonces la reacción se escribirá de la siguiente manera:
CH 4 + 2O 2 + 2 × 3.76N 2 \u003d CO 2 + 2H 2 O + 2 × 3.76N 2.
1 mol CH 4 +2 mol O 2 +7.52 mol N 2 \u003d 10.52 mol de una mezcla de O 2, N 2 y CH 4.
Entonces la composición estequiométrica de la mezcla será:
(1/10,52)*100%=9,5% CH4; (2/10,52)*100%=19,0% O2;
(7.52 / 10.52) * 100% \u003d 71.5% N 2.
Esto significa que en la mezcla más combustible, en lugar del 100% (CH 4 + O 2) en la reacción con el oxígeno, habrá un 24% (CH 4 + O 2) en la reacción con el aire, es decir se liberará mucho menos calor.
Se obtendrá la misma imagen si mezclamos composiciones arbitrarias no estequiométricas.
Por ejemplo, en la reacción 2CH 4 + 2O 2 \u003d CO 2 + 2H 2 O + CH 4 1 mol de CH 4 no pro-reacciona.
en reacción CH 4 + 4O 2 \u003d CO 2 + 2H 2 O + 2O 2 2 moles de O 2 no participan en la reacción, pero juegan el papel de lastre, requiriendo cierta cantidad de calor para su calentamiento.
Así, si comparamos las reacciones de combustión del metano en oxígeno y aire o en exceso de CH 4 y O 2, entonces es evidente que la cantidad de calor desprendido en la primera reacción será mayor que en las demás, ya que en ellas:
Menos concentraciones de reactivos en la mezcla total;
Parte del calor se gastará en calentar el lastre: nitrógeno, oxígeno o metano.
Hagamos preguntas:
¿Qué energía se puede liberar en la reacción?
Lo que determina la cantidad de calor, es decir. efecto térmico
¿Cuánta energía térmica se debe agregar a
¿reacción endotérmica?
Para ello, se introduce el concepto de contenido calorífico de una sustancia.
3.2 Contenido calorífico de las sustancias.
¿De dónde vino el calor en la reacción de combustión del metano? Así que estaba escondido en las moléculas de CH 4 y O 2, y ahora ha sido liberado.
Aquí hay un ejemplo de una reacción más simple:
2H 2 + O 2 \u003d 2H 2 O + Q
Esto significa que el nivel de energía de la mezcla estequiométrica de hidrógeno y oxígeno era más alto que el del producto de reacción H 2 O, y la energía "extra" se liberaba de la sustancia.
En la reacción inversa de la electrólisis del agua, es decir, descomposición del agua con la ayuda de la energía eléctrica, hay una redistribución de los átomos en la molécula de agua con la formación de hidrógeno y oxígeno. En este caso, aumenta el contenido de calor de H 2 y O 2.
Así, cada sustancia durante su formación recibe o cede cierta energía, y la medida de energía térmica acumulada por una sustancia durante su formación se llama contenido de calor, o entalpía.
A diferencia de la química, en la termodinámica química, el calor de formación de una sustancia no se denota con el símbolo Q, sino con el símbolo DH con un signo (+) si el calor es absorbido por un compuesto químico, y con un signo (-) si el calor se libera durante la reacción, es decir, “sale” de los sistemas.
Se denota el calor estándar de formación de 1 mol de una sustancia a una presión de 101,3 kPa y una temperatura de 298 K.
Los libros de referencia dan los calores de formación de compuestos a partir de sustancias simples.
Por ejemplo:
En CO 2 \u003d - 393.5 kJ / mol
U H 2 O gas \u003d - 241,8 kJ / mol
Pero para las sustancias formadas durante procesos endotérmicos, por ejemplo, acetileno C 2 H 2 \u003d + 226,8 kJ / mol, durante la formación de un átomo de hidrógeno H + según la reacción H 2 \u003d H + + H + \u003d + 217,9 kJ/mol.
Para sustancias puras que consisten en un elemento químico en una forma estable (H 2 , O 2 , C, Na, etc.), DH se toma convencionalmente igual a cero.
Sin embargo, si discutimos las propiedades macroscópicas de las sustancias, distinguimos varias formas de energía: cinética, potencial, química, eléctrica, térmica, energía nuclear y trabajo mecánico. Y si consideramos el problema a nivel molecular, entonces estas formas de energía pueden explicarse sobre la base de solo dos formas: la energía cinética del movimiento y la energía potencial en reposo de los átomos y las moléculas.
En las reacciones químicas, solo cambian las moléculas. Los átomos permanecen sin cambios. Energía Molécula es la energía de enlace de sus átomos, acumulada en la molécula. Está determinada por las fuerzas de atracción de los átomos entre sí. Además, existe una energía potencial de atracción de moléculas entre sí. Es pequeño en gases, mayor en líquidos e incluso mayor en sólidos.
Cada átomo tiene energía, parte de la cual está asociada con electrones y parte con el núcleo. Los electrones tienen la energía cinética de rotación alrededor del núcleo y la energía eléctrica potencial de atracción entre sí y repulsión entre sí.
La suma de estas formas de energía molecular es el contenido de calor de la molécula.
Si sumamos el contenido de calor de 6,02 × 10 23 moléculas de una sustancia, obtenemos el contenido de calor molar de esta sustancia.
Por qué el contenido de calor de las sustancias de un solo elemento (moléculas de un elemento) se toma como cero se puede explicar de la siguiente manera.
El DH de un elemento químico, es decir, la energía de su formación, está asociado a procesos intranucleares. La energía nuclear está asociada con las fuerzas de interacción de las partículas intranucleares y la transformación de un elemento químico en otro durante las reacciones nucleares. Por ejemplo, la reacción de desintegración del uranio:
o más simplemente: U+n®Ba+Kr+3n.
dónde: norte ’ o es una partícula de neutrones con masa 1 y carga cero.
El uranio captura un neutrón, como resultado de lo cual se divide (descompone) en dos nuevos elementos, bario y criptón, con la formación de 3 neutrones y se libera energía nuclear.
Debe decirse que millones de veces mayores cambios de energía están asociados con reacciones nucleares que con reacciones químicas. Por lo tanto, la energía de desintegración del uranio es de 4,5 × 10 9 kcal/mol × uranio. Esto es 10 millones de veces más que cuando se quema un mol de carbón.
En las reacciones químicas, los átomos no cambian, pero las moléculas sí. Por lo tanto, la energía de formación de átomos por parte de los químicos no se tiene en cuenta, y DH de moléculas de gas de un solo elemento y átomos de sustancias puras se toma igual a cero.
La reacción de descomposición del uranio anterior es un ejemplo clásico de una reacción en cadena. Más adelante consideraremos la teoría del mecanismo en cadena de la reacción de combustión. Pero, ¿de dónde viene el neutrón y qué lo hace reaccionar con el uranio? Esto se debe a la llamada energía de activación, que consideraremos un poco más adelante.
3.3. Efecto térmico de la reacción.
El hecho de que cada sustancia individual contenga una cierta cantidad de energía sirve como explicación de los efectos térmicos de las reacciones químicas.
Según la ley de Hess: El efecto térmico de una reacción química depende únicamente de la naturaleza de los productos inicial y final y no depende del número de reacciones intermedias de transición de un estado a otro.
Corolario 1 de esta ley: El efecto térmico de una reacción química es igual a la diferencia entre la suma de los calores de formación de los productos finales y la suma de los calores de formación de las sustancias de partida, teniendo en cuenta los coeficientes de las fórmulas de estas sustancias en la ecuación de reacción.
Por ejemplo, en la reacción 2H 2 +O 2 \u003d 2H 2 O ± DH.
![]() ;
; ![]() ; .
; .
Como resultado, la ecuación de reacción general se verá así:
2H 2 + O 2 \u003d 2H 2 O - 582 kJ / mol.
Y si DH tiene el signo (-), entonces la reacción es exotérmica.
consecuencia 2. Según la ley de Lavoisier-Laplace, el efecto térmico de la descomposición de un compuesto químico es igual y de signo opuesto al efecto térmico de su formación.
Entonces la reacción de descomposición del agua será:
2H 2 O \u003d 2H 2 + O 2 +582 kJ / mol, es decir esta reacción es endotérmica.
Un ejemplo de una reacción más compleja:
CH 4 + 2O 2 \u003d CO 2 + 2H 2 O.
Entonces la reacción se escribirá como:
CH 4 + 2O 2 \u003d CO 2 + 2H 2 O - 742,3 kJ / mol, lo que significa que la reacción es exotérmica.
3.4. Fundamentos cinéticos de las reacciones de gases.
De acuerdo con la ley de acción de masas, la velocidad de reacción a una temperatura constante es proporcional a la concentración de sustancias que reaccionan o, como se dice, "masas que actúan".
La velocidad de una reacción química ( υ ) es habitual considerar la cantidad de una sustancia que reacciona por unidad de tiempo ( dt) por unidad de volumen ( dV).
Considere la reacción que procede de acuerdo con la ecuación:
A + B = C + D.
Dado que la velocidad de reacción caracteriza una disminución en la concentración de reactivos con el tiempo y un aumento en la concentración de productos de reacción, podemos escribir:
![]() , (3.1)
, (3.1)
donde los menos en las derivadas indican la dirección del cambio en la concentración de los componentes, y las concentraciones de los componentes se indican entre corchetes.
Luego, una reacción irreversible directa en T \u003d const procede a una velocidad de:
![]() , (3.2)
, (3.2)
dónde: k es la constante de velocidad de una reacción química. No depende de la concentración de los componentes, sino que cambia solo con la temperatura.
De acuerdo con la ley de acción de masas, las concentraciones de los componentes de la reacción se incluyen en la ecuación cinética en un grado igual al coeficiente estequiométrico de este componente.
Entonces para la reacción
aA + bB = cC + dD
La ecuación cinética tiene la forma:
Los exponentes a, b, c, d generalmente se denominan órdenes de reacción para los componentes A, B, C, D, y la suma de los exponentes se denomina orden general de la reacción.
Por ejemplo, reacciones como
A ® bB + cC - ordeno,
2A \u003d bB + cC - II orden,
A + B \u003d cC + dD - III orden.
Dado que las concentraciones de todos los componentes que reaccionan están interconectadas por ecuaciones estequiométricas, las ecuaciones cinéticas de primer orden más simples son ecuaciones diferenciales de primer orden con una variable independiente, la concentración, y se pueden integrar.
La ecuación cinética más simple es la ecuación de primer orden del tipo
para cual ![]() . (3.4)
. (3.4)
Denotamos por la concentración del componente A antes del inicio de la reacción e, integrando la ecuación bajo la condición de frontera t=0, [A]=[A 0 ], obtenemos:
O [A]=×e - kt. (3.5)
Así, la dependencia de la velocidad de reacción de la concentración de sustancias es exponencial.
La energía cinética de los gases lo explica de esta manera. De acuerdo con la hipótesis de Arrhenius, la reacción entre moléculas tiene lugar solo si están activas, es decir, tienen un exceso de energía suficiente para romper los enlaces interatómicos, la llamada energía de activación E A.
Aquellos. la velocidad de una reacción química no depende del número de colisiones de todas las moléculas, sino solo de las activadas.
Según la ley de Boltzmann, el número de moléculas activas
n A \u003d n o * e - E / RT, (3.6)
donde: E es la energía de activación,
T es la temperatura de la mezcla de gases,
n o es el número total de moléculas.
Entonces el número de colisiones efectivas, coincidiendo con la velocidad de reacción, es igual a:
υ p \u003d Z eff \u003d Z 0 * e - E / RT, (3.7)
donde: Z 0 es el número total de colisiones moleculares.
1) la velocidad de reacción es proporcional a la concentración de moléculas activas, cuyo número depende de la temperatura y la presión en la mezcla, ya que la presión es el número de moléculas que chocan con cualquier superficie;
2) una reacción es posible solo si las moléculas que interactúan reciben una cierta cantidad de energía suficiente para romper o debilitar los enlaces interatómicos. La activación consiste en la transición de las moléculas a un estado en el que es posible la transformación química.
Muy a menudo, el proceso de activación procede a través de la formación de compuestos de átomos intermedios, inestables pero altamente activos.
Así, no sólo para la ocurrencia de procesos endotérmicos se necesita un aporte externo de energía, sino también para los exotérmicos. Para que ocurra una reacción exotérmica, se le debe impartir algún impulso de energía térmica. Por ejemplo, para que ocurra una reacción de combustión en una mezcla de hidrógeno y oxígeno, debe encenderse.
La cantidad mínima de energía térmica requerida para "comenzar" una reacción química se llama energía de activación.
3.5. Energía de activación de la reacción.
Para explicar este fenómeno, a menudo se utiliza el siguiente ejemplo (Fig. 9):
Hay una pelota en la plataforma. El sitio está ubicado frente a la colina. Por lo tanto, la pelota podría rodar hacia abajo por sí misma, si no fuera por el deslizamiento. Pero para un descenso espontáneo, debe subirse a la cima de la colina. En este caso, no solo se liberará la energía de subir la colina, sino también la energía de bajar.

Arroz. 9. Esquema de activación de la reacción.
Considere dos reacciones:
1) H 2 + O 2 \u003d H 2 O-
2) H 2 O \u003d H 2 + O 2 +
Como puede verse en la figura, E 2 =+E 1;
En general, para cualquier reacción
![]() .
.
Y el signo del efecto térmico depende de la diferencia entre E 1 y E 2, que son siempre positivas.
Así, la energía de activación es la energía necesaria para la transformación de las sustancias reaccionantes al estado de un complejo activo (romper enlaces interatómicos, unir moléculas, acumular energía en una molécula...).
Con un aumento en la temperatura de los gases, la proporción de moléculas activas (e - E / RT) aumenta bruscamente y, por lo tanto, la velocidad de reacción de acuerdo con una dependencia exponencial. Esta dependencia se puede ilustrar de la siguiente manera:

Arroz. 10. Dependencia de la velocidad de reacción de la temperatura: 1 - la velocidad de la 1ra reacción, 2 - la velocidad de la 2da reacción.
Como puede verse en la Figura 10, la velocidad de la primera reacción es menor que la velocidad de la segunda reacción y la energía de activación de la primera reacción es mayor que la E de la segunda. Y a la misma temperatura T 2 υ 2 > υ 1 . Cuanto mayor sea la energía de activación, mayor será la temperatura requerida para lograr una determinada velocidad de reacción.
La razón de esto es que cuando E es mayor, los enlaces interatómicos existentes en las moléculas de los componentes que reaccionan son más fuertes y se necesita más energía para vencer estas fuerzas. En este caso, la proporción de moléculas activas es correspondientemente menor.
De lo anterior se puede ver que la magnitud de la energía de activación es la característica más importante de un proceso químico. Determina la altura de la barrera de energía, cuya superación es una condición para que se produzca la reacción. Por otro lado, caracteriza la velocidad de reacción en función de la temperatura, es decir cuanto mayor sea la energía de activación, mayor será la temperatura para lograr una reacción dada.
3.6. Catálisis.
Además de aumentar la temperatura y la concentración de sustancias, para acelerar una reacción química, utilizan catalizadores, es decir. sustancias que se introducen en la mezcla de reacción, pero que no se consumen en la reacción, sino que la aceleran al disminuir la energía de activación.
El proceso de aumentar la velocidad de reacción con la ayuda de catalizadores se llama catálisis.
Los catalizadores participan en reacciones intermedias para crear un complejo activado al debilitar los enlaces en las moléculas de las sustancias iniciales, su descomposición, la adsorción de moléculas en la superficie del catalizador o la introducción de partículas activas de catalizador.
La naturaleza de la participación del catalizador se puede explicar mediante el siguiente esquema:
Reacción sin catalizador: A + B = AB.
Con catalizador X: A + X = AX ® AX + B = AB + X.
Presentamos una imagen similar a la que se muestra en la Fig. 9.

Arroz. 11. Esquema de la acción del catalizador: E b. gato y mi con gato son las energías de activación de la reacción sin catalizador y con catalizador, respectivamente.
Cuando se introduce un catalizador (Fig. 11), la reacción puede seguir un camino diferente con una barrera de energía más baja. Esta vía corresponde a un nuevo mecanismo de reacción a través de la formación de otro complejo activado. Y una nueva barrera de menor energía puede superar más partículas, lo que conduce a un aumento en la velocidad de reacción.
Cabe señalar que la energía de activación de la reacción inversa disminuye en la misma cantidad que la energía de activación de la reacción directa, es decir ambas reacciones se aceleran por igual, y los catalizadores no inician la reacción, solo aceleran la reacción, que puede ocurrir en su ausencia, pero mucho más lentamente.
Los productos de reacción intermedios pueden convertirse en catalizadores, entonces esta reacción se llama autocatalítica. Entonces, si la velocidad de las reacciones ordinarias disminuye a medida que se consumen los reactivos, entonces la reacción de combustión debida a la autocatálisis se autoacelera y es autocatalítica.
Muy a menudo, los sólidos se utilizan como catalizadores, que adsorben las moléculas de los reactivos. Durante la adsorción, los enlaces en las moléculas que reaccionan se debilitan y, por lo tanto, se facilita la reacción entre ellas.
¿Qué es la adsorción?
3.7. Adsorción.
Adsorción- absorción superficial de una sustancia de un medio gaseoso o solución por una capa superficial de otra sustancia - un líquido o un sólido.
Por ejemplo, la adsorción de gases tóxicos en la superficie del carbón activado utilizado en las máscaras antigás.
Distinguir entre adsorción física y química.
A físico adsorción, las partículas atrapadas conservan sus propiedades, y cuando químico– se forman compuestos químicos del adsorbato con el adsorbente.
El proceso de adsorción va acompañado de la liberación de calor. Para la adsorción física, es insignificante (1-5 kcal/mol), para la adsorción química es mucho mayor (10-100 kcal/mol). Por lo tanto, las reacciones químicas durante la catálisis pueden acelerarse.
Para los procesos de combustión y explosión, se pueden dar los siguientes ejemplos:
1. La temperatura de autoignición de una mezcla de H 2 + O 2 es de 500 0 C. En presencia de un catalizador de paladio, disminuye a 100 0 C.
2. Los procesos de combustión espontánea del carbón comienzan con la adsorción química de oxígeno en la superficie de las partículas de carbón.
3. Cuando se trabaja con oxígeno puro, el oxígeno se adsorbe bien en la ropa (adsorción física). Y en presencia de una chispa o una llama, la ropa se incendia con facilidad.
4. El oxígeno es bien adsorbido y absorbido por los aceites técnicos con la formación de una mezcla explosiva. La mezcla explota espontáneamente, sin fuente de ignición (absorción química).
Combustión
Combustión- un proceso físico y químico complejo de convertir los componentes de una mezcla combustible en productos de combustión con la liberación de radiación térmica, luz y energía radiante. La naturaleza de la combustión se puede describir como una oxidación rápida.
La combustión subsónica (deflagración), a diferencia de la explosión y la detonación, se produce a bajas velocidades y no está asociada con la formación de una onda de choque. La combustión subsónica incluye la propagación normal de la llama laminar y turbulenta, y la combustión supersónica incluye la detonación.
La combustión se divide en térmico y cadena. En el núcleo térmico la combustión es una reacción química capaz de proceder con autoaceleración progresiva debido a la acumulación de calor liberado. cadena la combustión se produce en casos de algunas reacciones en fase gaseosa a bajas presiones.
Se pueden proporcionar condiciones de autoaceleración térmica para todas las reacciones con efectos térmicos y energías de activación suficientemente grandes.
La combustión puede comenzar espontáneamente como resultado de la autoignición o iniciarse por ignición. Bajo condiciones externas fijas, la combustión continua puede proceder en modo estacionario, cuando las principales características del proceso -velocidad de reacción, poder de liberación de calor, temperatura y composición de los productos- no cambian en el tiempo, o en modo periódico cuando estas características fluctúan alrededor de sus valores medios. Debido a la fuerte dependencia no lineal de la velocidad de reacción con la temperatura, la combustión es muy sensible a las condiciones externas. Una misma propiedad de combustión determina la existencia de varios regímenes estacionarios en las mismas condiciones (efecto de histéresis).
El proceso de combustión se divide en varios tipos: flash, ignición, ignición, combustión espontánea, ignición espontánea, explosión y detonación. Además, existen tipos especiales de combustión: combustión lenta y combustión con llama fría. Flash - el proceso de combustión instantánea de vapores de líquidos inflamables y combustibles, causado por la exposición directa a una fuente de ignición. La ignición es el fenómeno de la ocurrencia de combustión bajo la influencia de una fuente de ignición. Encendido: encendido, acompañado de la aparición de una llama. Al mismo tiempo, el resto de la masa de la sustancia combustible permanece relativamente fría. La combustión espontánea es un fenómeno de fuerte aumento en la tasa de reacciones exotérmicas en una sustancia, que conduce a la combustión en ausencia de una fuente de ignición. El autoencendido es la combustión espontánea acompañada de la aparición de una llama. En condiciones de producción, el aserrín y los trapos aceitosos pueden encenderse espontáneamente. La gasolina, el queroseno puede encenderse espontáneamente. Una explosión es una transformación química rápida de una sustancia (combustión explosiva), acompañada de la liberación de energía y la formación de gases comprimidos capaces de producir trabajo mecánico.
Quema sin llama
A diferencia de la combustión convencional, cuando se observan zonas de llama oxidante y llama reductora, es posible crear condiciones para una combustión sin llama. Un ejemplo es la oxidación catalítica de compuestos orgánicos en la superficie de un catalizador adecuado, como la oxidación de etanol en negro de platino.
Combustión de estado sólido
Se trata de procesos exotérmicos de autoonda en mezclas de polvos inorgánicos y orgánicos, que no van acompañados de desprendimientos de gases perceptibles y conducen a la obtención de productos exclusivamente condensados. Las fases gaseosa y líquida se forman como sustancias intermedias que aseguran la transferencia de masa, pero no abandonan el sistema de combustión. Se conocen ejemplos de polvos reactivos en los que no se ha probado la formación de tales fases (tantalio-carbono).
Los términos triviales "combustión sin gas" y "combustión con llama sólida" se utilizan como sinónimos.
Un ejemplo de tales procesos es SHS (síntesis de alta temperatura autopropagante) en mezclas inorgánicas y orgánicas.
Latente
Tipo de combustión en la que no se forma llama y la zona de combustión se extiende lentamente a través del material. La combustión lenta se ve comúnmente en materiales porosos o fibrosos con un alto contenido de aire o impregnados con oxidantes.
Combustión autógena
Combustión autosostenida. El término se utiliza en tecnologías de incineración de residuos. La posibilidad de combustión autógena (autosostenida) de los residuos está determinada por el contenido máximo de componentes de lastre: humedad y cenizas. Basado en muchos años de investigación, el científico sueco Tanner propuso utilizar un esquema triangular con valores límite para determinar los límites de la combustión autógena: más del 25 % de combustibles, menos del 50 % de humedad y menos del 60 % de cenizas.
ver también
notas
Enlaces
Fundación Wikimedia. 2010 .
Sinónimos:Vea qué es "Burning" en otros diccionarios:
Proceso fisicoquímico en el que la transformación de una sustancia va acompañada de una intensa liberación de energía y transferencia de calor y masa con el medio ambiente. La combustión puede comenzar espontáneamente como resultado de la autoignición o ser iniciada por ... ... Gran diccionario enciclopédico
QUEMANDO, ardiendo, pl. no, cfr. (libro). Acción y estado según el cap. quemar. Gas ardiente. Alma ardiente. Diccionario explicativo de Ushakov. D.N. Ushakov. 1935 1940 ... Diccionario explicativo de Ushakov
Resplandor, juego, entusiasmo, resplandor, juego, despegue, euforia, elevación del espíritu, centelleo, brillantez, obsesión, fuego, pasión, chispa, inspiración, destello, inspiración, entusiasmo, vivacidad, pasión, combustión, ascenso Vocabulario ... . .. Diccionario de sinónimos
Combustión- COMBUSTIÓN, transformación química, que va acompañada de una intensa liberación de calor y transferencia de calor y masa con el medio ambiente. Puede comenzar espontáneamente (combustión espontánea) o como resultado de la ignición. Una propiedad característica de la capacidad de quemar ... ... Diccionario Enciclopédico Ilustrado
Química compleja. una reacción que se desarrolla en condiciones de autoaceleración progresiva asociada con la acumulación de calor o productos de reacción catalizadores en el sistema. Se pueden alcanzar temperaturas altas (hasta varios miles de K) durante el calentamiento hidrotermal y, a menudo, hay ... ... Enciclopedia Física
Proceso fisicoquímico en el que la transformación de una sustancia va acompañada de una intensa liberación de energía y transferencia de calor y masa con el medio ambiente. puede comenzar espontáneamente como resultado de la autoignición, o puede ser iniciado por ... ... Diccionario de Emergencias
Durante las reacciones químicas, se obtienen otras sustancias a partir de una sustancia (que no debe confundirse con las reacciones nucleares, en las que un elemento químico se convierte en otro).
Cualquier reacción química se describe mediante una ecuación química:
Reactivos → Productos de reacción
La flecha indica la dirección de la reacción.
Por ejemplo:
En esta reacción, el metano (CH 4) reacciona con el oxígeno (O 2), dando como resultado la formación de dióxido de carbono (CO 2) y agua (H 2 O), o mejor dicho, vapor de agua. Esta es exactamente la reacción que ocurre en su cocina cuando enciende un quemador de gas. La ecuación debe leerse así: una molécula de gas metano reacciona con dos moléculas de gas oxígeno, dando como resultado una molécula de dióxido de carbono y dos moléculas de agua (vapor).
Los números delante de los componentes de una reacción química se llaman coeficientes de reacción.
Las reacciones químicas son endotérmico(con absorción de energía) y exotérmico(con liberación de energía). La combustión de metano es un ejemplo típico de una reacción exotérmica.
Hay varios tipos de reacciones químicas. Los más comunes:
- reacciones compuestas;
- reacciones de descomposición;
- reacciones de sustitución simple;
- reacciones de sustitución doble;
- reacciones de oxidación;
- reacciones redox.
Reacciones de conexión
En una reacción compuesta, al menos dos elementos forman un producto:
2Na (t) + Cl 2 (g) → 2NaCl (t)- la formación de sal.
Se debe prestar atención a un matiz esencial de las reacciones compuestas: dependiendo de las condiciones de la reacción o de las proporciones de los reactivos involucrados en la reacción, el resultado puede ser diferentes productos. Por ejemplo, en condiciones normales de combustión del carbón, se obtiene dióxido de carbono:
C (t) + O 2 (g) → CO 2 (g)
Si no hay suficiente oxígeno, se forma monóxido de carbono mortal:
2C (t) + O2 (g) → 2CO (g)
Reacciones de descomposición
Estas reacciones son, por así decirlo, opuestas en esencia a las reacciones del compuesto. Como resultado de la reacción de descomposición, la sustancia se descompone en dos (3, 4...) elementos más simples (compuestos):
- 2H 2 O (g) → 2H 2 (g) + O 2 (g)- descomposición del agua
- 2H 2 O 2 (g) → 2H 2 (g) O + O 2 (g)- descomposición del peróxido de hidrógeno
Reacciones de sustitución simple
Como resultado de las reacciones de sustitución simple, el elemento más activo reemplaza al elemento menos activo en el compuesto:
Zn (t) + CuSO 4 (solución) → ZnSO 4 (solución) + Cu (t)
El zinc en la solución de sulfato de cobre desplaza al cobre menos activo, dando como resultado una solución de sulfato de zinc.
El grado de actividad de los metales en orden ascendente de actividad:
- Los más activos son los metales alcalinos y alcalinotérreos.
La ecuación iónica para la reacción anterior será:
Zn (t) + Cu 2+ + SO 4 2- → Zn 2+ + SO 4 2- + Cu (t)
El enlace iónico CuSO 4, cuando se disuelve en agua, se descompone en un catión de cobre (carga 2+) y un anión sulfato (carga 2-). Como resultado de la reacción de sustitución se forma un catión zinc (que tiene la misma carga que el catión cobre: 2-). Tenga en cuenta que el anión sulfato está presente en ambos lados de la ecuación, es decir, según todas las reglas de las matemáticas, se puede reducir. El resultado es una ecuación ion-molecular:
Zn (t) + Cu 2+ → Zn 2+ + Cu (t)
Reacciones de sustitución doble
En las reacciones de doble sustitución, ya se reemplazan dos electrones. Tales reacciones también se denominan reacciones de intercambio. Estas reacciones tienen lugar en solución para formar:
- sólido insoluble (reacción de precipitación);
- agua (reacciones de neutralización).
Reacciones de precipitación
Al mezclar una solución de nitrato de plata (sal) con una solución de cloruro de sodio, se forma cloruro de plata:
Ecuación molecular: KCl (solución) + AgNO 3 (p-p) → AgCl (t) + KNO 3 (p-p)
ecuación iónica: K + + Cl - + Ag + + NO 3 - → AgCl (t) + K + + NO 3 -
Ecuación iónica molecular: Cl - + Ag + → AgCl (t)
Si el compuesto es soluble, estará en solución en forma iónica. Si el compuesto es insoluble, precipitará y formará un sólido.
Reacciones de neutralización
Estas son reacciones entre ácidos y bases, como resultado de lo cual se forman moléculas de agua.
Por ejemplo, la reacción de mezclar una solución de ácido sulfúrico y una solución de hidróxido de sodio (lejía):
Ecuación molecular: H 2 SO 4 (p-p) + 2NaOH (p-p) → Na 2 SO 4 (p-p) + 2H 2 O (l)
ecuación iónica: 2H + + SO 4 2- + 2Na + + 2OH - → 2Na + + SO 4 2- + 2H 2 O (l)
Ecuación iónica molecular: 2H + + 2OH - → 2H 2 O (g) o H + + OH - → H 2 O (g)
Reacciones de oxidación
Estas son reacciones de interacción de sustancias con oxígeno gaseoso en el aire, en las que, por regla general, se libera una gran cantidad de energía en forma de calor y luz. Una reacción de oxidación típica es la combustión. Al comienzo de esta página, se da la reacción de la interacción del metano con el oxígeno:
CH 4 (g) + 2O 2 (g) → CO 2 (g) + 2H 2 O (g)
El metano se refiere a los hidrocarburos (compuestos de carbono e hidrógeno). Cuando un hidrocarburo reacciona con el oxígeno, se libera mucha energía térmica.
Reacciones redox
Estas son reacciones en las que se intercambian electrones entre los átomos de los reactivos. Las reacciones discutidas anteriormente también son reacciones redox:
- 2Na + Cl 2 → 2NaCl - reacción compuesta
- CH 4 + 2O 2 → CO 2 + 2H 2 O - reacción de oxidación
- Zn + CuSO 4 → ZnSO 4 + Cu - reacción de sustitución simple
Las reacciones redox más detalladas con una gran cantidad de ejemplos de resolución de ecuaciones por el método de balance de electrones y el método de media reacción se describen en la sección
La combustión es una reacción química de oxidación del combustible con oxígeno, que se desarrolla relativamente rápido con la liberación de una gran cantidad de calor.
Durante la combustión, los productos de la combustión se calientan a altas temperaturas.
La ecuación general para la combustión de cualquier gas hidrocarburo con oxígeno es la siguiente:
dónde metro y norte- respectivamente, el número de átomos de carbono e hidrógeno en la molécula
q es el efecto térmico de la reacción de oxidación.
La Tabla 3.1 muestra las reacciones de combustión de los principales gases combustibles con oxígeno.
Reacciones de combustión de gases combustibles con oxígeno.
Tabla 3.1
La Tabla 3.1 muestra las reacciones de oxidación de los gases combustibles más conocidos con oxígeno. Sin embargo, en condiciones reales, el agente oxidante (oxígeno) se suministra a la zona de combustión no en su forma pura, sino como parte del aire. Se sabe que el aire se compone principalmente de dos partes: oxígeno y nitrógeno. La composición del aire también incluye una pequeña cantidad de dióxido de carbono CO 2, así como gases raros. Dada su pequeña cantidad en la composición del aire, los despreciamos.
Por lo tanto, si tomamos el volumen de aire como 100%, entonces el contenido de oxígeno será 21% y nitrógeno 79%. Por lo tanto, el 1 metro 3 oxígeno en el aire representado 79/21 = 3,76 metro 3 nitrógeno, o 1 metro 3 oxígeno está contenido en 100/21 = 4,76 metro 3 aire.
Dadas las relaciones anteriores, podemos escribir la ecuación general para la combustión de hidrocarburos con aire:
La Tabla 3.2 muestra las ecuaciones para la reacción de combustión de gases combustibles con aire.
Cabe señalar que las ecuaciones dadas en las tablas 3.1 y 3.2 son estequiométricas, es decir una proporción tal de gas combustible y agente oxidante (oxígeno, aire) a la que se suministra al gas combustible la cantidad teóricamente requerida de agente oxidante. Sin embargo, en la práctica de la combustión de gases en condiciones reales, es necesario suministrar a la zona una cantidad de agente oxidante ligeramente mayor que la que se desprende de las ecuaciones estequiométricas. Esto se debe principalmente a la imperfección de la calidad de la mezcla del gas combustible y el oxidante.
Ecuaciones para reacciones de combustión de gases combustibles con aire.
Tabla 3.2
La relación entre el caudal real del oxidante (oxígeno o aire) y el requerido teóricamente se denomina coeficiente de exceso de aire y se denota α , es decir.:
dónde Vd– consumo de aire real;
vt es la cantidad teóricamente necesaria de aire.
La Tabla 3.3 muestra los valores de la cantidad teóricamente requerida de oxidante (oxígeno y aire), así como el volumen de productos de combustión durante la combustión 1 metro 3 proporción de gas y exceso de aire igual a 1 ( a = 1).
Cantidad teóricamente requerida de oxidante y el volumen de productos de combustión durante la combustión 1 metro 3 a las α = 1
Tabla 3.3
En los cálculos prácticos, a veces no conocemos la composición química de los gases, sino que solo se conoce el calor de combustión. Es necesario determinar la cantidad teóricamente necesaria de aire necesaria para una combustión completa 1 metro 3 gasolina.
Para este caso, existe una fórmula empírica D.I. Mendeleiev:
dónde Q norte- menor poder calorífico del gas, kJ/metro 3 .
Las ecuaciones para las reacciones de combustión de varios gases con oxígeno y aire reflejan solo la relación entre el combustible y el comburente, y no explican el mecanismo de estas reacciones. En condiciones reales, el proceso de combustión es mucho más complicado.
El científico soviético, académico N.N. Semenov. Según su teoría, en la llama de una mezcla gas-aire se producen reacciones en cadena de combustión de gases. Como resultado, se forman productos intermedios inestables en forma de átomos de radicales libres. De acuerdo con la teoría de N.N. La reacción de combustión de hidrógeno con oxígeno de Semenov no se reduce simplemente a la combinación de dos moléculas de hidrógeno y una de oxígeno para formar dos moléculas de agua. Durante la interacción de estos dos gases, primero se produce la formación de sustancias intermedias en forma de átomos de hidrógeno y oxígeno, y también se produce la formación de radicales hidroxilo OH libres.
Para iniciar el proceso de combustión, es necesario activar de alguna manera la mezcla combustible. En otras palabras, es necesario crear condiciones bajo las cuales los reactivos tengan una gran cantidad de energía. Esta reserva de energía es necesaria para la puesta en marcha del proceso de combustión. La reserva de energía anterior se puede crear calentando la mezcla de gas y aire a su temperatura de ignición. Esta energía, llamada energía de activación, se necesita principalmente para romper los enlaces intermoleculares existentes en los reactivos.
Durante el proceso de combustión, se forman constantemente nuevos enlaces junto con la destrucción de los antiguos. Cuando se forman nuevos enlaces, se produce una importante liberación de energía, mientras que la ruptura de los enlaces antiguos siempre va acompañada de costes energéticos. Debido a que en el proceso de combustión la energía liberada durante la formación de nuevos enlaces es de gran importancia en comparación con la energía gastada en la ruptura de enlaces antiguos, el efecto térmico total sigue siendo positivo.
La reacción del hidrógeno con el oxígeno es la más sencilla y estudiada. Por lo tanto, considere esta reacción ramificada con un ejemplo.
De acuerdo con la teoría de N.N. Semenov en el momento inicial de la reacción, como resultado de la energía de activación y la colisión de moléculas de hidrógeno y oxígeno, se forman dos radicales OH hidroxilo:
![]() . (3.5)
. (3.5)
El átomo de hidrógeno libre H, a su vez, reacciona con una molécula de oxígeno. Como resultado, se forma un radical hidroxilo OH y un átomo de oxígeno libre, es decir:
![]() . (3.7)
. (3.7)
El radical puede volver a entrar en una reacción química con el hidrógeno y nuevamente, como resultado de la reacción, formar agua e hidrógeno libre, y el átomo de oxígeno, a su vez, puede reaccionar con una molécula de hidrógeno, lo que conducirá a la formación de otra. radical OH y un átomo de hidrógeno H , es decir:
![]() . (3.8)
. (3.8)
El mecanismo anterior de la reacción en cadena de combustión de hidrógeno con oxígeno muestra la posibilidad de interacciones múltiples de un radical OH con átomos de hidrógeno. Como resultado de esta interacción, se forman moléculas de agua.
Por lo tanto, los átomos libres y los radicales son centros activos en la creación de una reacción en cadena.
La reacción de combustión del hidrógeno con oxígeno, que explica el mecanismo de reacción en cadena, se puede escribir de la siguiente manera:
H 2 O O + (H 2) ...
OH + (H 2 ) ® H + (O 2 ) ® OH + (H 2 ) ...
O + (H 2 ) ® OH + (H 2 ) ® H 2 O
H + (O 2 ) ® OH + H 2 ...
El mecanismo de combustión del monóxido de carbono con oxígeno es más complejo. Según científicos del Instituto de Física Química de la Academia de Ciencias de la URSS, el monóxido de carbono no reacciona con el oxígeno seco. También encontraron que la adición de una pequeña cantidad de hidrógeno o humedad a la mezcla conduce al inicio de la reacción de oxidación. Como resultado, se produce la siguiente secuencia de reacciones químicas:
H2O® OH + H; (3.10)
OH + CO® CO2 + H; (3.11)
H+O2®OH+O; (3.12)
CO + OH® CO2 + H; (3.13)
CO+O®CO2; (3.14)
H + O 2 \u003d OH + O (3.15)
Como se desprende de las reacciones químicas anteriores, la presencia de una pequeña cantidad de humedad conduce a la formación de hidroxilos y átomos libres en la zona de combustión. Como se señaló anteriormente, tanto los radicales hidroxilo como los átomos libres son los iniciadores de la creación y los portadores de la reacción en cadena.
Un mecanismo aún más complejo para la oxidación de hidrocarburos. Junto con algunas similitudes con el mecanismo de combustión de hidrógeno y monóxido de carbono, el mecanismo de combustión de hidrocarburos tiene una serie de diferencias significativas. Al analizar los productos de combustión, se encontró que contienen aldehídos y principalmente formaldehído (HCHO).
Considere el mecanismo de oxidación de hidrocarburos usando el más simple de ellos, el metano, como ejemplo. El mecanismo de oxidación del metano pasa por cuatro etapas, en cada una de las cuales ocurren las siguientes reacciones químicas:
En la primera etapa:
H+O2®OH+O; (3.16)
CH 4 + OH® CH 3 + H 2 O; (3.17)
CH 4 + O ® CH 2 + H 2 O. (3.18)
En la segunda etapa:
CH 3 + O 2 ® HCHO + OH; (3.19)
CH2+O2® HCHO+O; (3.20)
En la tercera etapa:
HCHO + OH ® HCO + H 2 O (3.21)
HCHO + O®CO + H2O; (3.22)
HCO + O 2 ® CO + O + OH (3.23).
En la cuarta etapa:
CO+O®CO2 (3.24)
Combustión (reacción)
(una. combustión, quema; norte. Brennen, Verbrennung; F. combustión; y. combustión) - una reacción de oxidación de flujo rápido, acompañada por la liberación de medios. cantidad de calor; suele acompañarse de un resplandor brillante (llama). En la mayoría de los casos, la hidrólisis actúa como agente oxidante, pero también son posibles procesos de hidrogenación en reacciones de otro tipo (hidrogenación de metales en nitrógeno, en halógenos). en lo fisico química a G. incluyen todos los exotérmicos. química procesos, en seres to-ryh. el papel lo juega la autoaceleración de la reacción, provocada por un aumento de la temperatura (mecanismo térmico) o la acumulación de partículas activas (mecanismo de difusión).
Un rasgo característico de G. es la presencia de una región espacialmente limitada de alta temperatura (llama), en la que el principal. parte de la quimica conversión de materiales de partida en productos de combustión y b.h. calor. La aparición de una llama se produce por ignición, lo que requiere el gasto de una determinada energía, pero la propagación de la llama a través de un sistema capaz de calentar se produce de forma espontánea, a una velocidad que depende del producto químico. propiedades del sistema, físico. y dinámica de gases procesos. Características técnicamente importantes del gas: el poder calorífico de la mezcla combustible y el teórico. (adiabático) temp-pa, que se lograría con la combustión completa del combustible sin pérdida de calor.
De toda la variedad de procesos gaseosos, generalmente según el estado de agregación del combustible y comburente, gasificación homogénea de gases premezclados y combustibles vaporosos en comburentes gaseosos, gasificación heterogénea (combustibles sólidos y líquidos en comburentes gaseosos), y gasificación de explosivos y pólvora (va sin transferencia de masa con el medio ambiente).
La más sencilla es la gasificación homogénea de gases mixtos. La velocidad de propagación de una llama laminar en un sistema de este tipo es físico-química. constante de la mezcla, dependiendo de la composición de la mezcla, presión, temperatura y mol. conductividad térmica.
La hidrólisis heterogénea es el proceso más común en la naturaleza y la tecnología. Su velocidad está determinada por la física. propiedades del sistema y condiciones específicas de combustión. Para gases de combustibles líquidos, la velocidad de su evaporación es de gran importancia, mientras que para gases sólidos, la velocidad de gasificación es de gran importancia. Así, en G. carbones es posible distinguir dos etapas. En la primera etapa (bajo la condición de calentamiento lento), se produce la liberación de componentes volátiles del carbón, y en la segunda etapa, la postcombustión del residuo de coque.
La propagación de la llama a través del gas conduce a la aparición de un movimiento de gas por un medio. distancia del frente de la llama. Si el ancho de la zona de reacción es pequeño, entonces la llama se puede representar como dinámica de gas. discontinuidad moviéndose a través del gas a velocidad subsónica. Esto es posible no solo en el caso de una mezcla homogénea, sino también para combustibles líquidos y sólidos suficientemente finamente dispersos suspendidos en un comburente. Dado que la componente de la velocidad de la llama normal a su frente no depende de la velocidad del gas mismo, se establece una forma completamente definida de la llama en un flujo de gas en movimiento durante el flujo de gas estacionario. G. en tales condiciones se proporciona el diseño correspondiente de los dispositivos de horno.
El movimiento del gas provocado por la aparición de una llama puede ser laminar o turbulento. La turbulencia del flujo, por regla general, conduce a una fuerte aceleración de la combustión y la aparición de acústica. perturbaciones en el flujo, que finalmente conducen a la aparición de choque, iniciando la detonación de la mezcla de gases. La posibilidad de transición gaseosa a detonación está determinada, además de las propiedades del propio gas, por el tamaño y la geometría del sistema.
G. los procesos de combustible se utilizan en la tecnología, osn. la tarea de quemar combustible se reduce a lograr máx. liberación de calor (eficiencia de combustión) durante un período de tiempo determinado. En las montañas De hecho, los métodos para desarrollar p y se basan en el uso del proceso G. ( cm. combustión in situ). En ciertas montañas.-geol. condiciones que surgen espontáneamente G. ( cm. La combustión espontánea del carbón, la combustión espontánea de la turba) puede provocar incendios endógenos. L. G. Bolkhovitinov.
Enciclopedia de montaña. - M.: Enciclopedia soviética. Editado por E. A. Kozlovsky. 1984-1991 .
Vea qué es "Combustión (reacción)" en otros diccionarios:
combustión- 3.3 combustión reacción de oxidación exotérmica de una sustancia, acompañada de al menos uno de los tres factores: llama, resplandor, humo. Fuente: GOST R 50588 2012: Agentes espumantes para la lucha contra incendios. Técnicas generales… … Diccionario-libro de referencia de términos de documentación normativa y técnica
Partidos ... Wikipedia
Química compleja. una reacción que se desarrolla en condiciones de autoaceleración progresiva asociada con la acumulación de calor o productos de reacción catalizadores en el sistema. Se pueden alcanzar temperaturas altas (hasta varios miles de K) durante el calentamiento hidrotermal y, a menudo, hay ... ... Enciclopedia Física
Procesos nucleares Desintegración radiactiva Desintegración alfa Desintegración beta Desintegración de racimo Desintegración doble beta Captura electrónica Captura de doble electrón Radiación gamma Conversión interna Transición isomérica Desintegración de neutrones Desintegración de positrones ... ... Wikipedia
Proceso fisicoquímico en el que la transformación de una sustancia va acompañada de una intensa liberación de energía y transferencia de calor y masa con el medio ambiente. puede comenzar espontáneamente como resultado de la autoignición, o puede ser iniciado por ... ... Diccionario de Emergencias
combustión- Una reacción de oxidación exotérmica de una sustancia, acompañada por al menos uno de tres factores: llama, resplandor, humo. [ST SEV 383 87] combustión Reacción exotérmica que se produce en condiciones de autoaceleración progresiva. ... ... Manual del traductor técnico
Proceso fisicoquímico en el que la transformación de una sustancia va acompañada de una intensa liberación de energía y transferencia de calor y masa con el medio ambiente. La combustión puede comenzar espontáneamente como resultado de la autoignición o ser iniciada por ... ... Gran diccionario enciclopédico
- (Combustión francesa e inglesa, Verbrennung alemana; chem.). Es costumbre llamar G. tales casos de interacción con el oxígeno del aire de cualquier cuerpo, que van acompañados de una liberación significativa de calor y, a veces, luz. En un sentido más general, puede... ... Enciclopedia de Brockhaus y Efron
Combustión- una reacción de oxidación exotérmica de una sustancia combustible, acompañada, por regla general, de radiación electromagnética visible y emisión de humo. G. se basa en la interacción de una sustancia combustible con un agente oxidante, con mayor frecuencia oxígeno en el aire. Distinguir… … Enciclopedia rusa de protección laboral.
COMBUSTIÓN- química compleja y de flujo rápido. transformación acompañada de la liberación de calor y luz. En el sentido estricto de G., la reacción de la combinación de una sustancia con oxígeno, pero G. puede ocurrir sin oxígeno, por ejemplo. hidrógeno, antimonio y otros metales se queman en cloro, y... ... Gran Enciclopedia Politécnica
- Deadpool - Solución de problemas
- No arranca ¿Cómo sobrevivir?
- Qué hacer si bioshock infinite no arranca
- Tutorial Nancy Drew: coartada en cenizas
- Spec Ops: The Line - revisión del juego, revisión Spec ops the line se bloquea en las misiones
- Recorrido del nivel 1 de escape de la habitación
- Procesar tomates con ácido bórico ¿Cuánto costarán 2 gramos de ácido bórico?
- Hierba de pepino (Borago)
- Bioinsecticida Lepidocid: finalidad, propiedades y procedimiento de aplicación Periodo de espera del lepidocida
- Cómo cambiar el idioma a ruso en Steam
- Dendrobium noble: cuidado de la habitación
- Morfología de las plantas conceptos generales - documento
- Plantación, propagación y cuidado del bambú en el hogar, foto Cultivo de bambú a partir de semillas.
- Cómo fortalecer la señal celular para Internet en el país
- El sánscrito revela el significado olvidado de las palabras rusas (2 fotos)
- El lenguaje más antiguo Sánscrito lenguaje de programación del futuro Lenguaje muerto Sánscrito
- ¿Quién tiene dominio sobre toda la tierra?
- Símbolos y amuletos de masones El famoso amuleto masónico para el dinero
- el padre de Hécate. Diosas oscuras. Origen y genealogía
- flota de la aerolínea nord wind