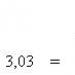Обратими и необратими реакции. Химично равновесие
Химичните реакции са обратими и необратими.
тези. ако някаква реакция A + B = C + D е необратима, това означава, че обратната реакция C + D = A + B не възниква.
т.е., например, ако определена реакция A + B = C + D е обратима, това означава, че и реакцията A + B → C + D (директна) и реакцията C + D → A + B (обратна) протичат едновременно ).
Всъщност, защото протичат както директните, така и обратните реакции, реагентите (изходните вещества) в случай на обратими реакции могат да бъдат наречени както вещества от лявата страна на уравнението, така и вещества от дясната страна на уравнението. Същото важи и за продуктите.
За всяка обратима реакция е възможно скоростите на правата и обратната реакция да са еднакви. Такова състояние се нарича състояние на равновесие.
В състояние на равновесие концентрациите както на всички реагенти, така и на всички продукти са непроменени. Концентрациите на продуктите и реагентите в равновесие се наричат равновесни концентрации.
Изместване на химичното равновесие под въздействието на различни фактори
Поради такива външни влияния върху системата като промяна в температурата, налягането или концентрацията на изходните вещества или продукти, равновесието на системата може да бъде нарушено. Въпреки това, след прекратяване на това външно влияние, след известно време системата ще премине в ново състояние на равновесие. Такъв преход на система от едно равновесно състояние в друго равновесно състояние се нарича изместване (изместване) на химичното равновесие .
За да можете да определите как химичното равновесие се измества с определен тип експозиция, е удобно да използвате принципа на Le Chatelier:
Ако върху система в състояние на равновесие се окаже външно въздействие, тогава посоката на изместване на химичното равновесие ще съвпадне с посоката на реакцията, която отслабва ефекта от въздействието.
Влиянието на температурата върху състоянието на равновесие
Когато температурата се промени, равновесието на всяка химична реакция се измества. Това се дължи на факта, че всяка реакция има топлинен ефект. В този случай топлинните ефекти на правата и обратната реакция винаги са директно противоположни. Тези. ако правата реакция е екзотермична и протича с топлинен ефект, равен на +Q, тогава обратната реакция винаги е ендотермична и има топлинен ефект, равен на -Q.
По този начин, в съответствие с принципа на Le Chatelier, ако увеличим температурата на някаква система, която е в състояние на равновесие, тогава равновесието ще се измести към реакцията, по време на която температурата намалява, т.е. към ендотермична реакция. И по същия начин, ако понижим температурата на системата в състояние на равновесие, равновесието ще се измести към реакцията, в резултат на което температурата ще се повиши, т.е. към екзотермична реакция.
Например, разгледайте следната обратима реакция и посочете къде ще се измести нейното равновесие с понижаване на температурата:
Както можете да видите от горното уравнение, предната реакция е екзотермична, т.е. в резултат на протичането му се отделя топлина. Следователно обратната реакция ще бъде ендотермична, т.е. протича с абсорбиране на топлина. Съгласно условието температурата се понижава, следователно равновесието ще се измести надясно, т.е. към директна реакция.
Влияние на концентрацията върху химичното равновесие
Увеличаването на концентрацията на реагентите в съответствие с принципа на Le Chatelier трябва да доведе до изместване на равновесието към реакцията, в която се изразходват реагентите, т.е. към директна реакция.
Обратно, ако концентрацията на реагентите се понижи, тогава равновесието ще се измести към реакцията, която води до образуването на реагентите, т.е. страна на обратната реакция (←).
Промяната в концентрацията на реакционните продукти също влияе по подобен начин. Ако увеличите концентрацията на продуктите, равновесието ще се измести към реакцията, в резултат на което продуктите се консумират, т.е. към обратната реакция (←). Ако, напротив, концентрацията на продуктите се понижи, тогава равновесието ще се измести към директната реакция (→), за да се увеличи концентрацията на продуктите.
Влияние на налягането върху химичното равновесие
За разлика от температурата и концентрацията, промяната в налягането не влияе на равновесното състояние на всяка реакция. За да може промяната в налягането да доведе до промяна в химичното равновесие, сумите на коефициентите пред газообразните вещества от лявата и дясната страна на уравнението трябва да са различни.
Тези. от две реакции:
промяната в налягането може да повлияе на състоянието на равновесие само в случай на втората реакция. Тъй като сумата от коефициентите пред формулите на газообразните вещества в случая на първото уравнение вляво и вдясно е една и съща (равна на 2), а в случая на второто уравнение е различна (4 в отляво и 2 отдясно).
От това по-специално следва, че ако няма газообразни вещества както сред реагентите, така и сред продуктите, тогава промяната в налягането няма да повлияе по никакъв начин на текущото състояние на равновесие. Например налягането няма да повлияе на равновесното състояние на реакцията:
Ако количеството на газообразните вещества е различно отляво и отдясно, тогава увеличаването на налягането ще доведе до изместване на равновесието към реакцията, при което обемът на газовете намалява, а намаляването на налягането - в посока на реакцията, в резултат на което обемът на газовете се увеличава.
Влияние на катализатора върху химичното равновесие
Тъй като катализаторът ускорява еднакво както предните, така и обратните реакции, неговото присъствие или отсъствие не влияедо състояние на равновесие.
Единственото нещо, на което може да повлияе катализаторът, е скоростта на преход на системата от неравновесно състояние към равновесно.
Въздействието на всички горепосочени фактори върху химичното равновесие е обобщено по-долу в измамен лист, който първо можете да надникнете, когато изпълнявате задачи за баланс. Тя обаче няма да може да го използва на изпита, следователно, след като анализира няколко примера с нейна помощ, тя трябва да бъде научена и обучена да решава задачи за баланс, като вече не наднича в нея:
Обозначения: T - температура, стр - налягане, с – концентрация, – повишаване, ↓ – намаление
|
T |
T - равновесието се измества към ендотермична реакция |
| ↓T - равновесието се измества към екзотермична реакция | |
|
стр |
стр - равновесието се измества към реакцията с по-малка сума от коефициенти пред газообразни вещества |
| ↓стр - равновесието се измества към реакцията с по-голяма сума от коефициенти пред газообразни вещества | |
|
° С |
° С (реагент) - равновесието се измества към директната реакция (надясно) |
| ↓c (реагент) - равновесието се измества към обратната реакция (наляво) | |
| ° С (продукт) - равновесието се измества в посока на обратната реакция (наляво) | |
| ↓c (продукт) - равновесието се измества към директната реакция (надясно) | |
| Не нарушава баланса! |
Химично равновесие и принципите на неговото изместване (принцип на Le Chatelier)
При обратими реакции при определени условия може да възникне състояние на химично равновесие. Това е състоянието, при което скоростта на обратната реакция става равна на скоростта на правата реакция. Но за да се измести равновесието в една или друга посока, е необходимо да се променят условията на реакцията. Принципът на изместване на равновесието е принципът на Le Chatelier.
Основни положения:
1. Външно въздействие върху система, която се намира в състояние на равновесие, води до изместване на това равновесие в посоката, в която ефектът от произведеното въздействие е отслабен.
2. С увеличаване на концентрацията на едно от реагиращите вещества, равновесието се измества към консумацията на това вещество, с намаляване на концентрацията, равновесието се измества към образуването на това вещество.
3. С увеличаване на налягането равновесието се измества към намаляване на количеството на газообразните вещества, т.е. към намаляване на налягането; когато налягането намалява, равновесието се измества в посока на увеличаване на количествата газообразни вещества, т.е. в посока на увеличаване на налягането. Ако реакцията протича без промяна на броя на молекулите на газообразните вещества, тогава налягането не влияе на равновесното положение в тази система.
4. С повишаване на температурата равновесието се измества към ендотермична реакция, с намаляване на температурата - към екзотермична реакция.
За принципите благодарим на ръководството "Началото на химията" Kuzmenko N.E., Eremin V.V., Popkov V.A.
USE задания за химическо равновесие (преди A21)
Задача номер 1.
H2S(g) ↔ H2(g) + S(g) - Q
1. Налягане
2. Повишаване на температурата
3. намаляване на налягането
Обяснение:като начало помислете за реакцията: всички вещества са газове и от дясната страна има две молекули продукти, а от лявата страна има само една, реакцията също е ендотермична (-Q). Затова вземете предвид промяната в налягането и температурата. Необходимо е равновесието да се измести към продуктите на реакцията. Ако увеличим налягането, тогава равновесието ще се измести към намаляване на обема, тоест към реагентите - това не ни устройва. Ако увеличим температурата, тогава равновесието ще се измести към ендотермичната реакция, в нашия случай към продуктите, което се изискваше. Верният отговор е 2.
Задача номер 2.
Химично равновесие в системата
SO3(g) + NO(g) ↔ SO2(g) + NO2(g) - Q
ще се измести към образуването на реагенти при:
1. Повишаване на концентрацията на NO
2. Повишаване концентрацията на SO2
3. Повишаване на температурата
4. Увеличаване на налягането
Обяснение:всички вещества са газове, но обемите от дясната и лявата страна на уравнението са еднакви, така че налягането няма да повлияе на равновесието в системата. Помислете за промяна в температурата: с повишаването на температурата равновесието се измества към ендотермична реакция, точно към реагентите. Верният отговор е 3.
Задача номер 3.
В системата
2NO2(g) ↔ N2O4(g) + Q
изместването на равновесието наляво ще допринесе за
1. Повишаване на налягането
2. Повишаване концентрацията на N2O4
3. Понижаване на температурата
4. Въвеждане на катализатор
Обяснение:Нека обърнем внимание на факта, че обемите на газообразните вещества в дясната и лявата част на уравнението не са равни, следователно промяната в налягането ще повлияе на равновесието в тази система. А именно, с увеличаване на налягането равновесието се измества към намаляване на количеството на газообразните вещества, тоест надясно. Не ни устройва. Реакцията е екзотермична, следователно промяната в температурата също ще повлияе на равновесието на системата. С намаляването на температурата равновесието ще се измести към екзотермичната реакция, тоест също надясно. С увеличаване на концентрацията на N2O4 равновесието се измества към потреблението на това вещество, тоест наляво. Верният отговор е 2.
Задача номер 4.
В реакция
2Fe(t) + 3H2O(g) ↔ 2Fe2O3(t) + 3H2(g) - Q
равновесието ще се измести към продуктите на реакцията
1. Налягане
2. Добавяне на катализатор
3. Добавяне на желязо
4. Добавяне на вода
Обяснение:броят на молекулите от дясната и лявата страна е еднакъв, така че промяната в налягането няма да повлияе на равновесието в тази система. Помислете за увеличаване на концентрацията на желязо - равновесието трябва да се измести към консумацията на това вещество, тоест надясно (към реакционните продукти). Верният отговор е 3.
Задача номер 5.
Химично равновесие
H2O(g) + C(t) ↔ H2(g) + CO(g) - Q
ще се измести към образуването на продукти в случай на
1. Повишаване на налягането
2. Повишаване на температурата
3. Увеличаване на времето на процеса
4. Приложения на катализатор
Обяснение:промяна в налягането няма да повлияе на равновесието в дадена система, тъй като не всички вещества са газообразни. С повишаване на температурата равновесието се измества към ендотермичната реакция, т.е. надясно (по посока на образуването на продукти). Верният отговор е 2.
Задача номер 6.
С увеличаването на налягането химичното равновесие ще се измести към продуктите в системата:
1. CH4(g) + 3S(t) ↔ CS2(g) + 2H2S(g) - Q
2. C(t) + CO2(g) ↔ 2CO(g) - Q
3. N2(g) + 3H2(g) ↔ 2NH3(g) + Q
4. Ca(HCO3)2(t) ↔ CaCO3(t) + CO2(g) + H2O(g) - Q
Обяснение:промяната в налягането не засяга реакции 1 и 4, следователно не всички участващи вещества са газообразни, в уравнение 2 броят на молекулите от дясната и лявата страна е еднакъв, така че налягането няма да бъде засегнато. Остава уравнение 3. Нека проверим: с увеличаване на налягането равновесието трябва да се измести към намаляване на количеството газообразни вещества (4 молекули отдясно, 2 молекули отляво), тоест към продуктите на реакцията. Верният отговор е 3.
Задача номер 7.
Не влияе върху изместването на баланса
H2(g) + I2(g) ↔ 2HI(g) - Q
1. Повишаване на налягането и добавяне на катализатор
2. Повишаване на температурата и добавяне на водород
3. Понижаване на температурата и добавяне на йодоводород
4. Добавяне на йод и добавяне на водород
Обяснение:в дясната и лявата част количествата газообразни вещества са еднакви, следователно промяната в налягането няма да повлияе на равновесието в системата и добавянето на катализатор също няма да повлияе, защото веднага щом добавим катализатор , пряката реакция ще се ускори, а след това незабавно обратната и равновесието в системата ще се възстанови. Верният отговор е 1.
Задача номер 8.
За изместване на равновесието надясно в реакцията
2NO(g) + O2(g) ↔ 2NO2(g); ∆H°<0
изисква се
1. Въвеждане на катализатор
2. Понижаване на температурата
3. Намаляване на налягането
4. Намалена концентрация на кислород
Обяснение:намаляването на концентрацията на кислород ще доведе до изместване на равновесието към реагентите (наляво). Намаляването на налягането ще измести равновесието в посока на намаляване на количеството газообразни вещества, тоест надясно. Верният отговор е 3.
Задача номер 9.
Добив на продукт при екзотермична реакция
2NO(g) + O2(g) ↔ 2NO2(g)
с едновременно повишаване на температурата и намаляване на налягането
1. Увеличете
2. Намаляване
3. Няма да се промени
4. Първо увеличете, след това намалете
Обяснение:когато температурата се повишава, равновесието се измества към ендотермична реакция, т.е. към продуктите, а когато налягането намалява, равновесието се измества към увеличаване на количеството на газообразните вещества, т.е. също наляво. Следователно добивът на продукта ще намалее. Верният отговор е 2.
Задача номер 10.
Увеличаване на добива на метанол в реакцията
CO + 2H2 ↔ CH3OH + Q
насърчава
1. Повишаване на температурата
2. Въвеждане на катализатор
3. Въвеждане на инхибитор
4. Повишаване на налягането
Обяснение:когато налягането се увеличи, равновесието се измества към ендотермична реакция, тоест към реагентите. Увеличаването на налягането измества равновесието към намаляване на количеството на газообразните вещества, т.е. към образуването на метанол. Верният отговор е 4.
Задачи за самостоятелно решаване (отговорите по-долу)
1. В системата
CO(g) + H2O(g) ↔ CO2(g) + H2(g) + Q
изместването на химичното равновесие към продуктите на реакцията ще допринесе за
1. Намалете налягането
2. Повишаване на температурата
3. Повишаване концентрацията на въглероден окис
4. Повишаване концентрацията на водород
2. В коя система с увеличаване на налягането равновесието се измества към продуктите на реакцията
1. 2CO2(g) ↔ 2CO(g) + O2(g)
2. С2Н4 (g) ↔ С2Н2 (g) + Н2 (g)
3. PCl3(g) + Cl2(g) ↔ PCl5(g)
4. H2(g) + Cl2(g) ↔ 2HCl(g)
3. Химично равновесие в системата
2HBr(g) ↔ H2(g) + Br2(g) - Q
ще се измести към реакционните продукти при
1. Налягане
2. Повишаване на температурата
3. намаляване на налягането
4. Използване на катализатор
4. Химично равновесие в системата
C2H5OH + CH3COOH ↔ CH3COOC2H5 + H2O + Q
се измества към реакционните продукти при
1. Добавяне на вода
2. Намаляване концентрацията на оцетна киселина
3. Повишаване на концентрацията на етер
4. При отстраняване на ест
5. Химично равновесие в системата
2NO(g) + O2(g) ↔ 2NO2(g) + Q
се измества към образуването на реакционния продукт при
1. Налягане
2. Повишаване на температурата
3. намаляване на налягането
4. Приложение на катализатора
6. Химично равновесие в системата
CO2 (g) + C (tv) ↔ 2CO (g) - Q
ще се измести към реакционните продукти при
1. Налягане
2. Понижаване на температурата
3. Повишаване на концентрацията на CO
4. Повишаване на температурата
7. Промяната на налягането няма да повлияе на състоянието на химичното равновесие в системата
1. 2NO(g) + O2(g) ↔ 2NO2(g)
2. N2(g) + 3H2(g) ↔ 2NH3(g)
3. 2CO(g) + O2(g) ↔ 2CO2(g)
4. N2(g) + O2(g) ↔ 2NO(g)
8. В коя система с увеличаване на налягането химичното равновесие ще се измести към изходните вещества?
1. N2(g) + 3H2(g) ↔ 2NH3(g) + Q
2. N2O4(g) ↔ 2NO2(g) - Q
3. CO2(g) + H2(g) ↔ CO(g) + H2O(g) - Q
4. 4HCl(g) + O2(g) ↔ 2H2O(g) + 2Cl2(g) + Q
9. Химично равновесие в системата
C4H10(g) ↔ C4H6(g) + 2H2(g) - Q
ще се измести към реакционните продукти при
1. Повишаване на температурата
2. Понижаване на температурата
3. Използване на катализатор
4. Намаляване концентрацията на бутан
10. За състоянието на химичното равновесие в системата
H2(g) + I2(g) ↔ 2HI(g) -Q
не влияе
1. Повишаване на налягането
2. Повишаване концентрацията на йод
3. Повишаване на температурата
4. Понижаване на температурата
Задачи за 2016г
1. Установете съответствие между уравнението на химическата реакция и изместването на химическото равновесие с увеличаване на налягането в системата.
Уравнение на реакцията Изместване на химичното равновесие
A) N2 (g) + O2 (g) ↔ 2NO (g) - Q 1. Преминава към директна реакция
B) N2O4 (g) ↔ 2NO2 (g) - Q 2. Преминава към обратната реакция
C) CaCO3 (tv) ↔ CaO (tv) + CO2 (g) - Q 3. Няма изместване на равновесието
D) Fe3O4(s) + 4CO(g) ↔ 3Fe(s) + 4CO2(g) + Q
2. Установете съответствие между външни влияния върху системата:
CO2 (g) + C (tv) ↔ 2CO (g) - Q
и изместване на химичното равновесие.
А. Повишаване на концентрацията на CO 1. Преминава към директна реакция
B. Намаляване на налягането 3. Няма промяна в равновесието
3. Установете съответствие между външни въздействия върху системата
HCOOH(l) + C5H5OH(l) ↔ HCOOC2H5(l) + H2O(l) + Q
Външно влияние Изместване на химичното равновесие
A. Добавяне на HCOOH 1. Измества към предна реакция
B. Разреждане с вода 3. Не се получава промяна в равновесието
D. Повишаване на температурата
4. Установете съответствие между външни въздействия върху системата
2NO(g) + O2(g) ↔ 2NO2(g) + Q
и промяна в химичното равновесие.
Външно влияние Изместване на химичното равновесие
А. Намаляване на налягането 1. Преминава към директна реакция
Б. Повишаване на температурата 2. Преминаване към обратната реакция
B. Повишаване на температурата на NO2 3. Не се получава изместване на равновесието
D. Добавяне на O2
5. Установете съответствие между външни въздействия върху системата
4NH3(g) + 3O2(g) ↔ 2N2(g) + 6H2O(g) + Q
и промяна в химичното равновесие.
Външно влияние Изместване на химичното равновесие
А. Намаляване на температурата 1. Преминаване към директна реакция
Б. Повишаване на налягането 2. Измества към обратната реакция
B. Увеличаване на концентрацията на амоняка 3. Няма промяна в равновесието
D. Отстраняване на водни пари
6. Установете съответствие между външни въздействия върху системата
WO3(s) + 3H2(g) ↔ W(s) + 3H2O(g) + Q
и промяна в химичното равновесие.
Външно влияние Изместване на химичното равновесие
А. Повишаване на температурата 1. Преминава към директна реакция
Б. Повишаване на налягането 2. Измества към обратната реакция
Б. Използване на катализатор 3. Не се получава изместване на равновесието
D. Отстраняване на водни пари
7. Установете съответствие между външни въздействия върху системата
С4Н8(g) + Н2(g) ↔ С4Н10(g) + Q
и промяна в химичното равновесие.
Външно влияние Изместване на химичното равновесие
А. Увеличаване на концентрацията на водород 1. Преминава към директна реакция
Б. Повишаване на температурата 2. Измества в посока на обратната реакция
B. Повишаване на налягането 3. Няма промяна в равновесието
D. Използване на катализатор
8. Установете съответствие между уравнението на химична реакция и едновременна промяна в параметрите на системата, водеща до изместване на химичното равновесие към директна реакция.
Уравнение на реакцията Промяна на параметрите на системата
A. H2(g) + F2(g) ↔ 2HF(g) + Q 1. Повишаване на температурата и концентрацията на водород
B. H2(g) + I2(tv) ↔ 2HI(g) -Q 2. Намаляване на температурата и концентрацията на водород
B. CO(g) + H2O(g) ↔ CO2(g) + H2(g) + Q 3. Повишаване на температурата и намаляване на концентрацията на водород
D. C4H10(g) ↔ C4H6(g) + 2H2(g) -Q 4. Намаляване на температурата и увеличаване на концентрацията на водород
9. Установете съответствие между уравнението на химическата реакция и изместването на химическото равновесие с увеличаване на налягането в системата.
Уравнение на реакцията Посока на изместване на химичното равновесие
A. 2HI(g) ↔ H2(g) + I2(tv) 1. Измества към директната реакция
B. C(g) + 2S(g) ↔ CS2(g) 2. Измества към обратната реакция
B. C3H6(g) + H2(g) ↔ C3H8(g) 3. Няма изместване на равновесието
H. H2(g) + F2(g) ↔ 2HF(g)
10. Установете съответствие между уравнението на химична реакция и едновременна промяна в условията за нейното провеждане, което води до изместване на химичното равновесие към директна реакция.
Уравнение на реакцията Променливи условия
A. N2(g) + H2(g) ↔ 2NH3(g) + Q 1. Повишаване на температурата и налягането
B. N2O4 (g) ↔ 2NO2 (g) -Q 2. Намаляване на температурата и налягането
B. CO2 (g) + C (твърд) ↔ 2CO (g) + Q 3. Повишаване на температурата и понижаване на налягането
D. 4HCl(g) + O2(g) ↔ 2H2O(g) + 2Cl2(g) + Q 4. Понижаване на температурата и повишаване на налягането
Отговори: 1 - 3, 2 - 3, 3 - 2, 4 - 4, 5 - 1, 6 - 4, 7 - 4, 8 - 2, 9 - 1, 10 - 1
1. 3223
2. 2111
3. 1322
4. 2221
5. 1211
6. 2312
7. 1211
8. 4133
9. 1113
10. 4322
За задачите благодарим на сборниците с упражнения за 2016, 2015, 2014, 2013 автори:
Кавернина А.А., Добротина Д.Ю., Снастина М.Г., Савинкина Е.В., Живейнова О.Г.
Преминаването на химическа система от едно състояние на равновесие в друго се нарича изместване (изместване) на баланса. Поради динамичния характер на химичното равновесие, то се оказва чувствително към външни условия и е в състояние да реагира на тяхната промяна.
Посоката на изместване на позицията на химичното равновесие в резултат на промяна на външните условия се определя от правилото, формулирано за първи път от френския химик и металург Анри Луи Льо Шателие през 1884 г. и наречено на негово име Принцип на Льо Шателие:
Ако върху система, която е в състояние на равновесие, се упражнява външно въздействие, тогава в системата възниква такова изместване на равновесието, което отслабва това влияние.
Има три основни параметъра, чрез промяна на които е възможно да се измести химичното равновесие. Това са температура, налягане и концентрация. Помислете за тяхното влияние върху примера на равновесна реакция:
1) Температурен ефект. Тъй като за тази реакция DH°<0, следовательно, прямая реакция идет с выделением тепла (+Q), а обратная реакция – с поглощением тепла (-Q):
2NO (G) + O 2 (G) 2NO 2 (G)
При повишаване на температурата, т.е. когато в системата се въведе допълнителна енергия, равновесието се измества към обратната ендотермична реакция, която изразходва тази излишна енергия. Когато температурата намалява, напротив, равновесието се измества в посоката на реакцията, която протича с отделянето на топлина, така че да компенсира охлаждането, т.е. равновесието се измества по посока на директната реакция.
С повишаването на температурата равновесието се измества към ендотермична реакция, която протича с поглъщане на енергия.
При понижаване на температурата равновесието се измества в посока на екзотермична реакция, която протича с освобождаване на енергия.
2) Обемен ефект. С увеличаване на налягането скоростта на реакцията протича с намаляване на обема (DV<0). При понижении давления ускоряется реакция, протекающая с увеличением объема (DV>0).
В хода на разглежданата реакция от 3 мола газообразни вещества се образуват 2 мола газове:
2NO (G) + O 2 (G) 2NO 2 (G)
3 мола газ 2 мола газ
V REF > V PROD
DV = V PROD - V REF<0
Следователно, с увеличаване на налягането, равновесието се измества към по-малък обем на системата, т.е. реакционни продукти. При понижаване на налягането равновесието се измества към изходните вещества, които заемат по-голям обем.
С увеличаване на налягането равновесието се измества към реакцията, протичаща с образуването на по-малък брой молове газообразни вещества.
С намаляването на налягането равновесието се измества в посока на протичане на реакцията с образуването на повече молове газообразни вещества.
3) Влияние на концентрацията. С увеличаване на концентрацията се увеличава скоростта на реакцията, според която въведеното вещество се изразходва. Всъщност, когато в системата се въведе допълнително количество кислород, системата го "изразходва" в потока на директна реакция. С намаляване на концентрацията на O 2 този недостатък се компенсира чрез разлагането на реакционния продукт (NO 2) в изходните материали.
С увеличаване на концентрацията на изходните вещества или намаляване на концентрацията на продуктите равновесието се измества към директна реакция.
С намаляване на концентрацията на изходните вещества или увеличаване на концентрацията на продуктите равновесието се измества в посока на обратната реакция.
Въвеждането на катализатор в системата не влияе на изместването на позицията на химичното равновесие, тъй като катализаторът еднакво увеличава скоростта както на правата, така и на обратната реакция.
9. Скоростта на химична реакция. Химично равновесие
9.2. Химично равновесие и неговото изместване
Повечето химични реакции са обратими, т.е. едновременно протичат както в посока на образуване на продуктите, така и в посока на тяхното разпадане (отляво надясно и отдясно наляво).
Примери за реакционни уравнения за обратими процеси:
N 2 + 3H 2 ⇄ t °, p, cat 2NH 3
2SO 2 + O 2 ⇄ t °, p, cat 2SO 3
H 2 + I 2 ⇄ t ° 2HI
Обратимите реакции се характеризират със специално състояние, което се нарича състояние на химично равновесие.
Химично равновесиеТова е състоянието на системата, при което скоростите на правата и обратната реакция се изравняват. При движение към химично равновесие скоростта на правата реакция и концентрацията на реагентите намаляват, докато обратната реакция и концентрацията на продуктите се увеличават.
В състояние на химично равновесие за единица време се образува толкова продукт, колкото се разпада. В резултат на това концентрациите на вещества в състояние на химично равновесие не се променят с времето. Това обаче изобщо не означава, че равновесните концентрации или маси (обеми) на всички вещества са непременно равни една на друга (виж фиг. 9.8 и 9.9). Химичното равновесие е динамично (подвижно) равновесие, което може да реагира на външни влияния.
Преминаването на равновесна система от едно равновесно състояние в друго се нарича изместване или изместване на баланса. На практика се говори за изместване на равновесието към продуктите на реакцията (вдясно) или към изходните материали (вляво); Директната реакция се нарича реакция, протичаща отляво надясно, а обратната реакция се нарича отдясно наляво. Състоянието на равновесие е показано с две противоположно насочени стрелки: ⇄.
Принципът на изместване на равновесиетое формулиран от френския учен Льо Шателие (1884 г.): външно влияние върху система в равновесие води до изместване на това равновесие в посока, която отслабва ефекта от външното влияние
Нека формулираме основните правила за изместване на равновесието.
Влияние на концентрацията: с увеличаване на концентрацията на дадено вещество равновесието се измества към неговото потребление, а при намаляване - към образуването му.
Например, с увеличаване на концентрацията на Н 2 в обратима реакция
H 2 (g) + I 2 (g) ⇄ 2HI (g)
скоростта на предната реакция, която зависи от концентрацията на водород, ще се увеличи. В резултат на това равновесието ще се измести надясно. С намаляване на концентрацията на Н2 скоростта на директната реакция ще намалее, в резултат на което равновесието на процеса ще се измести наляво.
Температурен ефект: когато температурата се повишава, равновесието се измества към ендотермична реакция, а когато се понижава, се измества към екзотермична реакция.
Важно е да запомните, че с повишаване на температурата скоростта на екзо- и ендотермичните реакции се увеличава, но в по-голям брой пъти - ендотермичната реакция, за която E a винаги е по-голяма. С понижаване на температурата скоростта на двете реакции намалява, но отново в по-голям брой пъти - ендотермично. Удобно е казаното да се онагледи с диаграма, в която стойността на скоростта е пропорционална на дължината на стрелките, а равновесието е изместено по посока на по-дългата стрелка.
Влияние на налягането: промяната в налягането засяга състоянието на равновесие само когато в реакцията участват газове и дори когато газообразното вещество е само в една част от химическото уравнение. Примери за реакционни уравнения:
- налягането влияе върху изместването на равновесието:
3H 2 (g) + N 2 (g) ⇄ 2NH 3 (g),
CaO (tv) + CO 2 (g) ⇄ CaCO 3 (tv);
- налягането не влияе на изместването на равновесието:
Cu (tv) + S (tv) = CuS (tv),
NaOH (разтвор) + HCl (разтвор) = NaCl (разтвор) + H 2 O (l).
При намаляване на налягането равновесието се измества към образуване на по-голямо химично количество газообразни вещества, а при повишаване към образуване на по-малко химично количество газообразни вещества. Ако химическите количества газове в двете части на уравнението са еднакви, тогава налягането не влияе на състоянието на химичното равновесие:
Н2 (g) + Cl2 (g) = 2HCl (g).
Казаното е лесно за разбиране, като се има предвид, че ефектът от промяната в налягането е подобен на ефекта от промяната в концентрацията: с увеличаване на налягането с n пъти, концентрацията на всички вещества в равновесие се увеличава с една и съща сума (и обратно).
Влияние на обема на реакционната система: промяната в обема на реакционната система е свързана с промяна в налягането и засяга само равновесното състояние на реакциите, включващи газообразни вещества. Намаляването на обема означава увеличаване на налягането и измества равновесието към образуването на по-малко химично количество газове. Увеличаването на обема на системата води до намаляване на налягането и изместване на равновесието към образуването на по-голямо химично количество газообразни вещества.
Въвеждането на катализатор в равновесна система или промяна в нейната природа не измества равновесието (не увеличава добива на продукта), тъй като катализаторът еднакво ускорява както предните, така и обратните реакции. Това се дължи на факта, че катализаторът еднакво намалява енергията на активиране на директните и обратните процеси. Тогава защо да използваме катализатор в обратими процеси? Факт е, че използването на катализатор в обратими процеси допринася за бързото настъпване на равновесие и това повишава ефективността на промишленото производство.
Конкретни примери за влиянието на различни фактори върху изместването на равновесието са дадени в табл. 9.1 за реакцията на синтез на амоняк, протичаща с отделяне на топлина. С други думи, правата реакция е екзотермична, а обратната реакция е ендотермична.
Таблица 9.1
Ефект на различни фактори върху изместването на равновесието в реакцията на синтез на амоняк
| Фактор на влияние върху равновесната система | Посоката на изместване на равновесието на реакцията 3 H 2 + N 2 ⇄ t, p, cat 2 NH 3 + Q |
|---|---|
| Увеличаване на концентрацията на водород, s (H 2) | Равновесието се измества надясно, системата реагира с намаляване на c (H 2) |
| Намаляване на концентрацията на амоняк, s (NH 3) ↓ | Равновесието се измества надясно, системата реагира с увеличаване на c (NH 3) |
| Увеличаване на концентрацията на амоняк, s (NH 3) | Равновесието се измества наляво, системата реагира с намаляване на c (NH 3) |
| Намаляване на концентрацията на азот, s (N 2)↓ | Равновесието се измества наляво, системата реагира с увеличаване на c (N 2) |
| Компресия (намаляване на обема, повишаване на налягането) | Равновесието се измества надясно, в посока на намаляване на обема на газовете |
| Разширяване (увеличаване на обема, намаляване на налягането) | Равновесието се измества наляво, в посока на увеличаване на обема на газа |
| Увеличаване на налягането | Равновесието се измества надясно, към по-малък обем газ |
| спад на налягането | Равновесието се измества наляво, към повече газове |
| Покачване на температурата | Равновесието се измества наляво, към ендотермична реакция |
| Температурен спад | Равновесието се измества надясно, към екзотермична реакция |
| Инжектиране на катализатор | Балансът не се променя |
Пример 9.3. В равновесие на процеса
2SO 2 (g) + O 2 (g) ⇄ 2SO 3 (g)
концентрациите на вещества (mol / dm 3) SO 2, O 2 и SO 3, съответно, са 0,6, 0,4 и 0,2. Намерете началните концентрации на SO 2 и O 2 (началната концентрация на SO 3 е нула).
Решение. Следователно по време на реакцията се изразходват SO 2 и O 2
c ref (SO 2) \u003d c равно (SO 2) + c отпадъци (SO 2),
c ref (O 2) = c е равно на (O 2) + c out (O 2).
Стойността на c се намира от c (SO 3):
x \u003d 0,2 mol / dm 3.
c ref (SO 2) \u003d 0,6 + 0,2 \u003d 0,8 (mol / dm 3).
y \u003d 0,1 mol / dm 3.
c ref (O 2) \u003d 0,4 + 0,1 \u003d 0,5 (mol / dm 3).
Отговор: 0,8 mol / dm 3 SO 2; 0,5 mol/dm 3 O 2 .
При изпълнение на изпитни задачи често се бърка влиянието на различни фактори, от една страна, върху скоростта на реакцията, а от друга страна, върху изместването на химичното равновесие.
За обратим процес
с повишаване на температурата скоростта както на правата, така и на обратната реакция се увеличава; при понижаване на температурата скоростта както на правата, така и на обратната реакция намалява;
с увеличаване на налягането се увеличават скоростите на всички реакции, протичащи с участието на газове, както директни, така и обратни. С намаляване на налягането скоростта на всички реакции, протичащи с участието на газове, намалява, както директни, така и обратни;
въвеждането на катализатор в системата или замяната му с друг катализатор не измества равновесието.
Пример 9.4. Протича обратим процес, описан с уравнението
N 2 (g) + 3H 2 (g) ⇄ 2NH 3 (g) + Q
Помислете кои фактори: 1) увеличават скоростта на синтез на реакцията на амоняк; 2) изместете равновесието надясно:
а) понижаване на температурата;
б) повишаване на налягането;
в) намаляване на концентрацията на NH3;
г) използване на катализатор;
д) повишаване на концентрацията на N 2 .
Решение. Фактори b), d) и e) увеличават скоростта на реакцията на синтеза на амоняк (както и повишаване на температурата, повишаване на концентрацията на H 2); изместване на равновесието надясно - а), б), в), д).
Отговор: 1) b, d, e; 2) a, b, c, e.
Пример 9.5. По-долу е енергийна диаграма на обратима реакция

Избройте всички верни твърдения:
а) обратната реакция протича по-бързо от предната;
б) с повишаване на температурата скоростта на обратната реакция се увеличава с по-голям брой пъти от пряката реакция;
в) директната реакция протича с поглъщане на топлина;
г) стойността на температурния коефициент γ е по-голяма за обратната реакция.
Решение.
а) Твърдението е правилно, тъй като E a rev = 500 - 300 = 200 (kJ) е по-малко от E a pr = 500 - 200 = 300 (kJ).
б) Твърдението е невярно, скоростта на пряката реакция нараства с по-голям брой пъти, за което E a е по-голямо.
в) Твърдението е правилно, Q pr = 200 - 300 = -100 (kJ).
г) Твърдението е невярно, γ е по-голямо за директна реакция, при която E a е по-голямо.
Отговор: а), в).
Състоянието на равновесие за обратима реакция може да продължи неопределено дълго време (без външна намеса). Но ако върху такава система се приложи външно въздействие (за промяна на температурата, налягането или концентрацията на крайните или изходните вещества), тогава състоянието на равновесие ще бъде нарушено. Скоростта на една от реакциите ще стане по-голяма от скоростта на другата. С течение на времето системата отново ще влезе в равновесно състояние, но новите равновесни концентрации на първоначалните и крайните вещества ще се различават от първоначалните. В този случай се говори за изместване на химичното равновесие в една или друга посока.
Ако в резултат на външно въздействие скоростта на правата реакция стане по-голяма от скоростта на обратната реакция, това означава, че химичното равновесие се е изместило надясно. Ако, напротив, скоростта на обратната реакция се увеличи, това означава, че химичното равновесие се е изместило наляво.
Когато равновесието се измести надясно, равновесните концентрации на изходните вещества намаляват, а равновесните концентрации на крайните вещества се увеличават в сравнение с първоначалните равновесни концентрации. Съответно, добивът на реакционни продукти също се увеличава.
Изместването на химичното равновесие наляво води до увеличаване на равновесните концентрации на изходните вещества и намаляване на равновесните концентрации на крайните продукти, чийто добив в този случай ще намалее.
Посоката на изместване на химичното равновесие се определя с помощта на принципа на Льо Шателие: „Ако се упражнява външен ефект върху система, която е в състояние на химично равновесие (промяна на температурата, налягането, концентрацията на едно или повече вещества, участващи в реакцията), ), то това ще доведе до увеличаване на скоростта на тази реакция, чийто ход ще компенсира (намали) въздействието.
Например, с увеличаване на концентрацията на изходните вещества скоростта на директната реакция се увеличава и равновесието се измества надясно. С намаляване на концентрацията на изходните вещества, напротив, скоростта на обратната реакция се увеличава и химичното равновесие се измества наляво.
При повишаване на температурата (т.е. при нагряване на системата) равновесието се измества към протичане на ендотермична реакция, а при понижаване (т.е. при охлаждане на системата) се измества към възникване на екзотермична реакция. (Ако правата реакция е екзотермична, тогава обратната реакция задължително ще бъде ендотермична и обратно).
Трябва да се подчертае, че повишаването на температурата, като правило, увеличава скоростта както на правата, така и на обратната реакция, но скоростта на ендотермичната реакция се увеличава в по-голяма степен от скоростта на екзотермичната реакция. Съответно, когато системата се охлажда, скоростите на правата и обратната реакция намаляват, но също не в същата степен: за екзотермична реакция тя е много по-малка, отколкото за ендотермична.
Промяната в налягането засяга промяната в химичното равновесие само ако са изпълнени две условия:
необходимо е поне едно от веществата, участващи в реакцията, да е в газообразно състояние, например:
CaCO 3 (t) CaO (t) + CO 2 (g) - промяната в налягането влияе върху изместването на равновесието.
CH 3 COOH (l.) + C 2 H 5 OH (l.) CH 3 COOS 2 H 5 (l.) + H 2 O (l.) - промяната в налягането не влияе на промяната в химичното равновесие, т.к. нито едно от изходните или крайните вещества не е в газообразно състояние;
ако няколко вещества са в газообразно състояние, е необходимо броят на газовите молекули от лявата страна на уравнението за такава реакция да не е равен на броя на газовите молекули от дясната страна на уравнението, например:
2SO 2 (g) + O 2 (g) 2SO 3 (g) - промяната на налягането влияе върху изместването на равновесието
I 2 (g) + Н 2 (g) 2НI (g) - промяната на налягането не влияе на изместването на равновесието
Когато тези две условия са изпълнени, повишаването на налягането води до изместване на равновесието към реакцията, протичането на която намалява броя на газовите молекули в системата. В нашия пример (каталитично изгаряне на SO 2) това ще бъде директна реакция.
Намаляването на налягането, напротив, измества равновесието в посока на реакцията, протичаща с образуването на по-голям брой газови молекули. В нашия пример това ще бъде обратната реакция.
Увеличаването на налягането води до намаляване на обема на системата, а оттам и до увеличаване на моларните концентрации на газообразните вещества. В резултат на това скоростта на правата и обратната реакция се увеличава, но не в същата степен. Намаляването на едно и също налягане по подобен начин води до намаляване на скоростите на правата и обратната реакция. Но в същото време скоростта на реакцията, към която се измества равновесието, намалява в по-малка степен.
Катализаторът не влияе на изместването на равновесието, т.к той ускорява (или забавя) еднакво както предната, така и обратната реакция. В негово присъствие химичното равновесие се установява само по-бързо (или по-бавно).
Ако системата е засегната от няколко фактора едновременно, тогава всеки от тях действа независимо от другите. Например при синтеза на амоняк
N 2 (газ) + 3H 2 (газ) 2NH 3 (газ)
реакцията се извършва при нагряване и в присъствието на катализатор, за да се увеличи скоростта й. Но в същото време ефектът от температурата води до факта, че равновесието на реакцията се измества наляво, към обратната ендотермична реакция. Това води до намаляване на отделянето на NH3. За да се компенсира този нежелан ефект на температурата и да се увеличи добивът на амоняк, едновременно с това се повишава налягането в системата, което измества реакционното равновесие надясно, т.е. към образуването на по-малък брой газови молекули.
В същото време емпирично се избират най-оптималните условия за протичане на реакцията (температура, налягане), при които тя да протича с достатъчно висока скорост и да дава икономически изгоден добив на краен продукт.
Принципът на Le Chatelier се използва по подобен начин в химическата промишленост при производството на голям брой различни вещества от голямо значение за националната икономика.
Принципът на Le Chatelier е приложим не само за обратими химични реакции, но и за различни други равновесни процеси: физически, физикохимични, биологични.
Тялото на възрастен се характеризира с относително постоянство на много параметри, включително различни биохимични показатели, включително концентрацията на биологично активни вещества. Такова състояние обаче не може да се нарече равновесие, т.к не се отнася за отворени системи.
Човешкото тяло, както всяка жива система, непрекъснато обменя различни вещества с околната среда: консумира храна и освобождава продуктите от тяхното окисляване и разпадане. Следователно тялото се характеризира стабилно състояние, дефинирано като постоянство на неговите параметри при постоянна скорост на обмен на материя и енергия с околната среда. В първото приближение стационарното състояние може да се разглежда като поредица от равновесни състояния, свързани помежду си с процеси на релаксация. В състояние на равновесие концентрациите на веществата, участващи в реакцията, се поддържат чрез попълване на първоначалните продукти отвън и отстраняване на крайните продукти навън. Промяната на тяхното съдържание в организма не води, за разлика от затворените системи, до ново термодинамично равновесие. Системата се връща в първоначалното си състояние. По този начин се поддържа относително динамично постоянство на състава и свойствата на вътрешната среда на тялото, което определя стабилността на неговите физиологични функции. Това свойство на живата система се нарича по различен начин хомеостаза.
В хода на живота на организъм в стационарно състояние, за разлика от затворена равновесна система, има увеличение на ентропията. Заедно с това обаче протича и обратният процес - намаляване на ентропията поради консумацията на хранителни вещества с ниска ентропийна стойност от околната среда (например високомолекулни съединения - протеини, полизахариди, въглехидрати и др.) и освобождаване на продукти от гниене в околната среда. Според позицията на И. Р. Пригожин общото производство на ентропия за организъм в стационарно състояние се стреми към минимум.

Голям принос за развитието на неравновесната термодинамика има И. Р. Пригожи, носител на Нобелова награда през 1977 г., който заявява, че „във всяка неравновесна система има локални области, които са в равновесие. В класическата термодинамика равновесието се отнася за цялата система, а в неравновесната - само за отделните й части.
Установено е, че ентропията в такива системи нараства в периода на ембриогенезата, по време на процесите на регенерация и растеж на злокачествени новообразувания.
- Deadpool - Отстраняване на неизправности
- Не започва Как да оцелея?
- Какво да направите, ако bioshock infinite не стартира
- Разходка Нанси Дрю: Алиби в пепелта
- Spec Ops: The Line - преглед на играта, преглед Spec ops линията се срива на мисии
- Инструкция за бягство от стаята ниво 1
- Обработка на домати с борна киселина Колко ще 2 грама борна киселина
- Краставична трева (Бораго)
- Биоинсектицид Лепидоцид: предназначение, свойства и начин на приложение Период на изчакване Лепидоцид
- Как да смените езика на руски в steam
- Dendrobium noble: грижа за стаята
- Морфология на растенията общи понятия - документ
- Засаждане, размножаване и грижи за бамбук у дома, снимка Отглеждане на бамбук от семена
- Как да подсилим клетъчния сигнал за интернет в страната
- Санскритът разкрива забравеното значение на руските думи (2 снимки)
- Най-старият език санскрит програмен език на бъдещето Мъртъв език санскрит
- Кой владее над цялата земя?
- Символи и амулети на масоните Известният масонски амулет за пари
- Бащата на Хеката. Тъмни богини. Произход и генеалогия
- флота на авиокомпанията nord wind