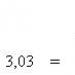Charakteristika spaľovacieho procesu. Mechanizmus chemických reakcií pri spaľovaní
Strana 1
Chemické spaľovacie reakcie začínajú po vytvorení počiatočného plameňa v pripravenej zmesi paliva a vzduchu. V piestových spaľovacích motoroch vzniká buď elektrickou iskrou alebo zahriatím palivovej kazety na teplotu, pri ktorej sa v objeme zmesi samovoľne objaví veľa počiatočných plameňov a zmes sa samovoľne zapáli.
K chemickej spaľovacej reakcii nedochádza za všetkých podmienok zrážky molekúl horľavého plynu s molekulami kyslíka.
Ak chemické reakcie horenia nie sú autokatalytické, potom jediným dôvodom šírenia plameňa môže byť prenos tepla zo spaľovacích produktov nespálenej zmesi. Tento typ šírenia plameňa sa nazýva tepelný. To samozrejme v žiadnom prípade nevylučuje možnosť, že k difúzii reaktantov a reakčných produktov dochádza súčasne, takže zloženie reakčnej zmesi v reakčnej zóne sa líši od zloženia východiskovej zmesi. Ale v tomto prípade nie je difúzia príčinou šírenia plameňa, ale len sprievodným faktorom. To platí najmä pre reťazové reakcie s nerozvetvenými reťazcami. Difúzia voľných atómov a radikálov, ak sú len v termodynamickej rovnováhe alebo v kvázistacionárnych koncentráciách, nemôže byť príčinou šírenia plameňa, ktorý zostáva tepelný. Úloha difúzie je plne zohľadnená v správnej tepelnej teórii šírenia plameňa, ako bude ukázané v ďalšej časti.
Ak chemické reakcie horenia nie sú autokatalytické, potom môže byť príčinou šírenia plameňa iba prenos tepla zo splodín horenia nespálenej zmesi. Tento typ šírenia plameňa sa nazýva tepelný. To samozrejme v žiadnom prípade nevylučuje možnosť, že k difúzii reaktantov a reakčných produktov dochádza súčasne, takže zloženie reakčnej zmesi v reakčnej zóne sa líši od zloženia východiskovej zmesi. Ale v tomto prípade nie je difúzia príčinou šírenia plameňa, ale len sprievodným faktorom. To platí najmä pre reťazové reakcie s nerozvetvenými reťazcami. Difúzia voľných atómov a radikálov, ak sú len v termodynamickej rovnováhe alebo v kvázistacionárnych koncentráciách, nemôže byť príčinou šírenia plameňa, ktorý zostáva tepelný. Úloha difúzie je plne zohľadnená v správnej tepelnej teórii šírenia plameňa, ako bude ukázané v ďalšej časti.
Rýchlosť chemických reakcií spaľovania plynu so vzduchom v horákoch je veľmi vysoká. Tieto reakcie pri vysokých teplotách prebiehajú v tisícinách sekundy. Doba horenia prúdu zmesi plynu a vzduchu je určená kontinuálnym prísunom čerstvých častí plynu a vzduchu, ktoré sa spaľujú v dôsledku rýchleho výskytu oxidačných reakcií pôsobením tepelného toku.
Rýchlosť chemických reakcií spaľovania plynu so vzduchom v horákoch je veľmi vysoká. Tieto reakcie pri vysokých teplotách prebiehajú v tisícinách sekundy. Doba horenia prúdu zmesi plynu a vzduchu je určená kontinuálnym prísunom čerstvých častí plynu a vzduchu, ktoré sa spaľujú v dôsledku rýchleho výskytu oxidačných reakcií pôsobením tepelného toku.
Kvantitatívne pomery chemických reakcií spaľovania možno získať so známymi molekulovými hmotnosťami i látok a hustotami p c / 22 4 plynov za normálnych fyzikálnych podmienok.
Mechanizmus inhibície chemických spaľovacích reakcií nie je dobre známy. Štúdie uskutočnené v posledných rokoch však umožňujú vytvoriť si určité predstavy o povahe účinku inhibítorov na plamene.
Predpokladajme, že chemická reakcia horenia prebehne úplne a produktmi reakcie sú vodná para H20, oxid uhličitý CO2, alebo v neprítomnosti kyslíka oxid uhoľnatý CO. Pre stechiometrickú vodíkovo-kyslíkovú (výbušnú) horľavú zmes, vydelením tepla tvorby vodnej pary 58 kcal / mol tepelnou kapacitou 8 cal / mol-deg, dostaneme teplotu spaľovania 7250 stupňov. Pre prípad úplného spálenia pevného uhlíka v kyslíku (St 02CO2 94 kcal/mol) získame ešte vyššiu teplotu spaľovania, 11 750 K. Teploty rovnakého rádu sa získajú aj pre iné uhľovodíkové palivá. Fantasticky vysoké teploty spaľovania, ktoré sú tu uvedené, sa vzťahujú na plazmatický stav hmoty, v skutočnosti sa nevyskytujú; teploty spaľovania kyslíkových zmesí sa pohybujú v rozmedzí 3000–4000 K.
Keďže zahrievanie a chemická reakcia spaľovania zmesi prebieha veľmi rýchlo, hlavným faktorom obmedzujúcim dĺžku spaľovacieho procesu je čas strávený miešaním plynu a vzduchu.
| Schémy organizácie spaľovania horľavých plynov. Spaľovanie. a - kinetická, b - difúzna, c - zmiešaná. |
Pretože rýchlosť chemických reakcií spaľovania pri vysokých teplotách ohniska je neúmerne vyššia ako rýchlosť tvorby zmesi, v praxi sa rýchlosť spaľovania plynu vždy rovná rýchlosti miešania plynu so vzduchom. Táto okolnosť uľahčuje riadenie rýchlosti spaľovania plynu v najširšom rozsahu. Zmiešaný spôsob spaľovania horľavých plynov je medzistupeň medzi kinetickým a difúznym.
Preto rovnica pre bilanciu chemickej reakcie horiacich sviečok za určitých podmienok je skutočne prvým pokusom o zavedenie množstva tepla do popisu chemickej reakcie.
Pri zostavovaní rovníc chemických reakcií horenia látok na vzduchu sa postupuje nasledovne: na ľavej strane sa píše horľavá látka a vzduch podieľajúci sa na horení, za rovnítkom sa píšu výsledné produkty reakcie. Napríklad je potrebné sformulovať rovnicu pre spaľovaciu reakciu metánu vo vzduchu. Najprv sa zapíše ľavá strana reakčnej rovnice: chemický vzorec metánu plus chemické vzorce látok, ktoré tvoria vzduch.
Ukážky vyhotovenia s/r2
CHEMICKÁ TERMODYNAMIKA. ROVNOVÁHA. KINETIKY.
ÚLOHA 1. Teplo spaľovania paliva.
Máme zmes plynového paliva: 50 % CH 4 + 50 % C 4 H 10.
Celkový objem V=1000 l=1m 3 .
1. Napíšte chemické rovnice spaľovacích reakcií zložiek plynu danej palivovej zmesi.
Reakcia spaľovania metánu:
CH4 (g) + 202 (g) ® CO2 (g) + 2H20 (g)
Reakcia horenia butánu:
C4H10 (g) + 13/202 (g)®4C02 (g) + 5H20 (g).
Entalpia Δ r H 0 298 z týchto chemických reakcií je spaľovacie teplo plynného paliva Δ H 0 sg.
2. Vypočítajte, koľko tepla možno získať spaľovaním daného objemu palivovej zmesi daného zloženia (objemové %), podmienky považujeme za normálne.
Pomocou Hessovho zákona vypočítame spalné teplo plynného paliva Δ H 0 sg pri štandardnom stave a 298 K, s použitím tabuľkových údajov (pozri prílohu, tabuľka) o vzniku tepla všetkých látok zapojených do spaľovacej reakcie (Δ f H 0 298):
pre metán
Δ H 0 sg CH4 = Δ r H 0 298 = A f H 0 CO2 + Δ f H 0 H2O - Δ f H 0 CH4 - 2A f H 0 O2 =
393,62+2. (-285,84) - (-74,78) - 0 \u003d -802,28 kJ / mol.
pre bután
Δ H 0 sg С4Н10 = Δ r H 0 298 = 4A f H 0 CO2 + 5Δ f H 0 H2O - Δ f H 0 С4Н10 - 13/2Δ f H 0 O2 =
štyri . (- 393,62) + 5 . (-285,84) - (-126,15) - 0 \u003d -2877,53 kJ / mol.
Špecifické spalné teplo plynného paliva Q T:
Q T = - (Δ H sg. 1 000 / 22,4), kJ / m 3,
kde 22,4 l/mol je molárny objem plynu pri n.o.s.
pre metán
Q T, CH4 \u003d - (-802,28. 1000 / 22,4) \u003d 35816 kJ / m3.
pre bután
Q T, C4H10 \u003d - (-2877,53, 1000 / 22,4) \u003d 128461 kJ/m3.
Celkové množstvo tepla získaného spaľovaním danej palivovej zmesi, berúc do úvahy objemy plynov:
Q = Q T, CH4 . V CH4+ Q T, С4Н10 . V С4Н10 =
35816. (1,0,5)+128461. (1,0,5) = 82138,5 kJ.
3. Vyberte energeticky najúčinnejšie palivo z danej palivovej zmesi. Vypočítajte špecifické spalné teplo tohto paliva Q T kJ/m 3 . Vypočítajte minimálny objem tohto paliva na výrobu 100 MJ tepla.
Energeticky najúčinnejším palivom v tejto palivovej zmesi je bután, špecifické spalné teplo Q T, C4H10 \u003d 128461 kJ/m3.
Na získanie 100 MJ tepla je potrebné spáliť:
V С4Н10 = Q/ Q T, С4Н10 \u003d 100 000 / 128461 \u003d 0,778 m 3 \u003d 778 l.
ÚLOHA 2. Chemická termodynamika.
1. Napíšte rovnice termochemickej reakcie, ktorej tepelným účinkom je vznikové teplo všetkých reaktantov danej chemickej reakcie.
Pre chemickú reakciu
CO2 (g) + C (c) "2CO (g)
Látka C (c) je jednoduchá, stabilná pri 298 K a tlaku 100 kPa, entalpia jej vzniku D H 0 f , 298 , = 0.
Rovnice termochemickej reakcie, ktorej tepelným účinkom je teplo tvorby činidiel pre danú chemickú reakciu CO 2 (g) a CO (g):
02 (g) + C (c) "C02 (g), D H 0 f , 298 \u003d -393,51 kJ / mol,
(pozri tabuľku);
1/202 (g) + C (c) "CO (g), D H 0 f , 298 \u003d -110,5 kJ / mol,
(pozri tabuľku).
2. Vypočítajte hodnoty entalpieD r H 0 298 , entropiaD r S 0 298 . tab. k úlohám 1, 2) pri štandardnom stave (s.s.) všetkých činidiel a teplote 298 K. Urobte záver o tepelnom účinku reakcie.
Podľa tabuľkových údajov (pozri tabuľku) zapíšeme termodynamické funkcie stavu činidiel danej chemickej reakcie pri štandardnom stave a 298 K.
Pomocou Hessovho zákona vypočítame entalpiu Δ r H 0 298, entropia ∆ r S 0 298 a Gibbsovej energie Δ r G 0 298 chemická reakcia v štandardnom stave a 298 K:
Δ r H 0 298 = 2Δ f H 0 298 COg - Δ f H 0 298 Sk - Δ f H 0 298 CO2g =
2(-110,5) - 0 - (-393,5) = 172,5 kJ.
Δ r H 0 298 >0 - reakcia je endotermická, prebieha s absorpciou tepla.
∆ r S 0 298 = 2 S 0 f , 298, CO(g) - S 0 f , 298,C(k) - S 0 f , 298,CO2 (g) = 2 (197,54) - 5,74 - 213,68 =
175,66 J/K.
∆ r S 0 298 >0 - systém sa stal neusporiadanejším v dôsledku tvorby dodatočného množstva plynu.
3. Vypočítajte Gibbsovu energiuD r G 0 298 daná chemická reakcia (položka 1. tab. k úlohám 1, 2) pri štandardnom stave (s.s.) všetkých činidiel a teplote 298 K. Určte, ktorým smerom bude táto reakcia pri štandardnom stave všetkých činidiel a teplote 298 K spontánne prebiehať.
Δ r G 0 298 = 2Δ f G 0 298 COg - Δ f G 0 298 Sk - Δ f G 0 298 CO2g =
2(-137,14) - 0 - (-394,38) = 120,15 kJ.
Δ r G 0 298 >0 - spontánna reakcia v doprednom smere pri štandardnom stave a 298 K je nemožná. Reakcia prebieha v opačnom smere.
4. Určite teplotný rozsah, pri ktorom je možný spontánny výskyt priamej reakcie v štandardnom stave všetkých činidiel bez zohľadnenia závislosti D r H 0 aD r S 0 od teploty. Nakreslite Gibbsovu energiu reakcie v závislosti od teplotyD r G 0 = f (T ).
Možnosť spontánnej reakcie v štandardnom stave je určená nerovnosťou ∆ r G 0 T < 0.
Tie. , ak
∆ r
G 0
T
=
∆ r
H 0 298
+∆ r
s 0
p dT- T∆ r
S 0
298
-
T
 ∆ r
s 0
p /
T)dT
<
0
∆ r
s 0
p /
T)dT
<
0
∆ r G 0 T ≈ ∆ r H 0 298 - T∆ r S 0 298 < 0
∆ r G 0 T = (172,5 – T . 175,66 . 10 -3) < 0 , отсюда T> 982 K.
Zápletka D r G 0 = f (T):
 ∆ r G 0
T
∆ r G 0
T
298 982 2300 T
Ak vezmeme do úvahy teplotné rozsahy existencie činidiel, teplotný rozsah spontánnej reakcie v štandardnom stave je 982< T< 2300 К.
5. Vypočítajte Gibbsovu energiuD r G 298 chemická reakcia pri daných hodnotách parciálnych tlakov plynov (bod 2. tab. k úlohám 1, 2) a teplote 298 K. Určte, či sa pri zmene parciálnych tlakov plynov oproti štandardnému stavu zmení smer procesu pri 298 K.
Výpočet Gibbsovej energie chemickej reakcie pri akejkoľvek teplote a akýchkoľvek relatívnych parciálnych tlakoch plynov sa vykonáva podľa rovnice van't Hoffovej izotermy:
Δ r G T =
∆
r G 0
T
+ RT ln  .
.
Vypočítajte Δ r G 298 pri 298 K a tlakoch plynu: R CO = 2. 10 3 Pa,
R CO2 = 8. 10 5 Pa.
Relatívne parciálne tlaky plynov:
 SO
= 2. 103 Pa / 105 Pa = 0,02;
SO
= 2. 103 Pa / 105 Pa = 0,02;
 CO2 = 8. 105 Pa / 105 Pa = 8.
CO2 = 8. 105 Pa / 105 Pa = 8.
Δ r G 298 = A r G 0 298 + RTln(R 2 CO / R CO2) = 120,15 + 8,31. 10-3. 298. ln(0,02/8) =
Δ r G 298 >0 - spontánna reakcia v doprednom smere pri daných parciálnych tlakoch plynov a 298 K je nemožná. Reakcia prebieha v opačnom smere.
6. Určite, ako chcete (teoreticky) zmeniť parciálny tlak ktoréhokoľvek zo zdrojových plynov (R ALE aleboR AT) zmeniť smer procesu v porovnaní so štandardným stavom pri 298 K a štandardnom parciálnom tlaku všetkých ostatných zložiek chemickej reakcie.
V štandardnom stave a 298 K môže reakcia spontánne prebiehať v opačnom smere, pretože Δ r G 0 298 >0.
Pre zmenu smeru procesu oproti štandardnému stavu pri 298 K môžete zmeniť parciálny tlak CO 2 (stav všetkých ostatných komponentov je štandardný). Podmienkou spontánneho toku reakcie v doprednom smere je Δ r G 298 < 0.
Podľa van't Hoffovej izotermickej rovnice:
Δ r G T =
∆
r G 0
T
+ RT ln  <
0
<
0
Δ r G 298
=
120,15 + 8,31. 10-3. 298 ln  < 0
< 0
Riešime nerovnosť ln
 <
- 48,5и
получаем:
<
- 48,5и
получаем:
 <
10 -21
.
<
10 -21
.
Touto cestou, R SO< R CO2 ≈ 10 5-krát.
Teda zmeniť smer procesu oproti štandardnému stavu pri 298 K a tlaku R CO = 10 5 Pa, je potrebné zvýšiť parciálny tlak CO 2 10 5-krát, t.j. parciálny tlak CO2 by mal byť: R CO2 > 1025 Pa.
Pri tomto tlaku CO2 môže daná chemická reakcia spontánne prebiehať v smere dopredu pri 298 K.
ÚLOHA 2. chemická bilancia.
Pre chemickú reakciu
CO2 (g) + C (c) "2CO (g)
1. Vypočítajte Gibbsovu energiuD r G 0 T a rovnovážna konštantaKomu R tejto reakcie pri štandardnom stave a teplotách 298 K, 500 K, 800 K, 1000 K, berúc do úvahy závislosťD r H 0 T aD r S 0 T na teplote pri konštantnej hodnote mernej tepelnej kapacity látoks R = konšt . Plot Dependency Plot
Komu R = f (T ).
Vypočítajme zmenu tepelnej kapacity systému (∆ r c 0 R= konštanta):
∆ r s 0 R = 2s 0 R 298 COg - s 0 R 298 sk - s 0 R 298 CO2g =
2. (29,14) – 8,54 – 37,41 = 12,33 J/K.
Vypočítajme Gibbsovu energiu chemickej reakcie pri štandardnom stave a daných teplotách 298 K, 500 K, 800 K, 1000 K, berúc do úvahy závislosť ∆ r H 0 T a ∆ r S 0 T na teplote s ohľadom na konštantnú hodnotu mernej tepelnej kapacity látok s R , podľa vzorca:
∆ r G 0 T = ∆ r H 0 T - T . ∆ r S 0 T = ∆ r G 0 298 + ∆ r s 0 R (T - 298) –T . ∆ r s 0 R ln(T / 298).
∆ r G 0 298 =120,15 kJ;
∆ r G 0 500 = 120,15 + 12,33. 10-3. (500-298) - 500. 12.33. 10-3. ln(500/298)=
∆ r G 0 800 = 120,15 + 12,33. 10-3. (800-298) - 800. 12.33. 10-3. ln(800/298)=
∆ r G 0 1000 \u003d 120,15 + 12,33. 10-3. (1000-298) - 1000. 12.33. 10-3. ln(1000/298) =
Termodynamický stav chemickej rovnováhy: ∆ r G T = 0.
Gibbsova energia chemickej reakcie v štandardnom stave
∆ r G 0 T súvisí s rovnovážnou konštantou Komu R podľa pomeru:
∆ r G 0 T = - RT ln Komu R
Po vypočítaní hodnoty ∆ r G 0 T reakcií, vypočítajte rovnovážnu konštantu Komu R podľa vzorca:
K p=exp(- ∆G 0 T /RT) ,
kde R\u003d 8,31 J / mol. K je univerzálna plynová konštanta.
K p, 298 = exp(- ∆G 0 T , 298 / R. 298) = exp(-120,15/8,31,10-3,298) =8. 10-22;
K p, 500 = exp(- ∆G 0 T , 500 / R. 500) = exp(-84,67 / 8,31 . 10 -3, 500) = 1,4. 10-9;
K p, 800 = exp(- ∆G 0 T , 800 / R. 800) = exp(-31,97 / 8,31 . 10 -3, 800) = 8,1. 10-3;
K p, 1000 = exp(- ∆G 0 T , 1000 / R. 1 000) \u003d exp (3,16 / 8,31. 10 -3, 1000) \u003d 1,46.
So zvyšovaním teploty sa zvyšuje rovnovážna konštanta, čo sa vysvetľuje endotermickým tepelným účinkom tejto reakcie
( Δ r H 0
T>0).
Δ r H 0
T>0).

2. Vyberte ľubovoľnú teplotu z oblasti spontánnej reakcie v smere dopredu. Pri tejto teplote vypočítajte rovnovážne koncentrácie plynných činidiel, ak boli ich počiatočné koncentrácie rovnaké (pozri kapitolu 3 tabuľky pre úlohy 1 a 2).
O T\u003d 1000 K, reakcia prebieha spontánne v smere dopredu, pretože ∆ r G 0 1000 = - 3,16 kJ<0, K p , 1000 = 1,46.
Zvolíme teplotu T= 1000 na výpočet rovnovážnych koncentrácií plynných činidiel, ak boli počiatočné koncentrácie plynných činidiel CO 2 a CO rovnaké: s CO2 = 0,5 mol/l, s CO = 0.
Výrazy pre rovnovážne konštanty vyjadrené ako relatívne rovnovážne parciálne tlaky plynov ( R rovná sa ) a rovnovážne koncentrácie ( s rovná sa):
Komu R
=
 ;
Komu s
=
;
Komu s
=

K p a K s súvisia cez rovnicu plynného skupenstva:
K s, 1000
=
 =
=
 =
0,018
=
0,018
kde R\u003d 0,082 l. atm/mol. K je univerzálna plynová konštanta;
∆ν \u003d 2-1 \u003d 1 (zmena počtu mólov plynných látok počas reakcie).
Tabuľka materiálovej bilancie:
Do výrazu pre dosadíme rovnovážne koncentrácie plynných činidiel K s a vyriešiť algebraickú rovnicu pre X:
Komu s
=
 = 0,018 , X= 0,0387 mol/l
= 0,018 , X= 0,0387 mol/l
OD CO sa rovná = 2. 0,0387 = 0,0774 mol/l
OD CO2 sa rovná \u003d 0,5 - 0,0387 \u003d 0,4613 mol / l.
Spaľovanie je pre ľudí jedným z najzaujímavejších a životne dôležitých prírodných javov. Spaľovanie je pre človeka užitočné, pokiaľ sa nedostane z podriadenia sa jeho racionálnej vôli. V opačnom prípade môže dôjsť k požiaru. Oheň - ide o nekontrolované pálenie, ktoré spôsobuje materiálne škody, poškodzuje životy a zdravie občanov, záujmy spoločnosti a štátu. Znalosť procesu horenia je nevyhnutná pre prevenciu a elimináciu požiaru.
Spaľovanie je chemická oxidačná reakcia sprevádzaná uvoľňovaním tepla. Spaľovanie vyžaduje prítomnosť horľavej látky, oxidačného činidla a zdroja vznietenia.
horľavá látka Akákoľvek pevná, kvapalná alebo plynná látka, ktorá sa môže oxidovať uvoľňovaním tepla.
Oxidačné činidlá môžu byť chlór, fluór, bróm, jód, oxidy dusíka a iné látky. Vo väčšine prípadov počas požiaru dochádza k oxidácii horľavých látok vzdušným kyslíkom.
Zdroj zapaľovania poskytuje energetický účinok na horľavú látku a okysličovadlo, čo vedie k horeniu. Zdroje vznietenia sa zvyčajne delia na otvorené (svetelné) - blesk, plameň, iskry, žeravé predmety, svetelné žiarenie; a skryté (nesvietivé) - teplo chemických reakcií, mikrobiologických procesov, adiabatického stlačenia, trenia, nárazov atď. Majú rôzne teploty plameňa a ohrevu. Každý zdroj vznietenia musí mať dostatočnú zásobu tepla alebo energie, aby mohol byť odovzdaný reaktantom. Preto aj trvanie vystavenia zdroju vznietenia ovplyvňuje proces spaľovania. Po spustení spaľovacieho procesu je podporovaný tepelným žiarením z jeho zóny.
Forma horľavého a oxidačného činidla palivový systém ktoré môžu byť chemicky nehomogénne alebo homogénne. V chemicky nehomogénnom systéme sa horľavá látka a oxidačné činidlo nezmiešajú a majú rozhranie (pevné a kvapalné horľavé látky, prúdy horľavých plynov a pár vstupujúce do vzduchu). Počas spaľovania takýchto systémov atmosférický kyslík nepretržite difunduje cez produkty horenia do horľavej látky a potom vstupuje do chemickej reakcie. Takéto spaľovanie sa nazýva difúzia. Rýchlosť difúzneho horenia je nízka, pretože je spomalená difúznym procesom. Ak je horľavá látka v plynnom, parnom alebo prašnom stave už zmiešaná so vzduchom (pred zapálením), potom je takýto horľavý systém homogénny a proces jeho horenia závisí len od rýchlosti chemickej reakcie. V tomto prípade spaľovanie prebieha rýchlo a je tzv kinetická.
Spaľovanie môže byť úplné alebo neúplné. Úplné spálenie nastane, keď kyslík vstúpi do spaľovacej zóny v dostatočnom množstve. Ak nie je dostatok kyslíka na oxidáciu všetkých produktov zapojených do reakcie, dochádza k neúplnému spaľovaniu. Medzi produkty úplného spaľovania patrí oxid uhličitý a oxid siričitý, vodná para, dusík, ktoré nie sú schopné ďalšej oxidácie a horenia. Produktmi nedokonalého spaľovania sú oxid uhoľnatý, sadze a produkty rozkladu látky pôsobením tepla. Vo väčšine prípadov je spaľovanie sprevádzané výskytom intenzívneho svetelného žiarenia - plameňa.
Existuje množstvo druhov horenia: záblesk, zapálenie, zapálenie, samovznietenie, samovznietenie, výbuch.
Flash - ide o rýchle spaľovanie horľavej zmesi bez vzniku zvýšeného tlaku plynu. Množstvo tepla, ktoré sa vytvorí počas záblesku, nestačí na pokračovanie horenia.
oheň - ide o výskyt horenia pod vplyvom zdroja vznietenia.
Zapaľovanie - zapálenie sprevádzané objavením sa plameňa. Zároveň zostáva zvyšok hmoty horľavej látky relatívne chladný.
Spontánne spaľovanie - jav prudkého zvýšenia rýchlosti exotermických oxidačných reakcií v látke, čo vedie k jej horeniu v neprítomnosti vonkajšieho zdroja vznietenia. V závislosti od vnútorných príčin sa procesy samovznietenia delia na chemické, mikrobiologické a tepelné. Chemické samovznietenie Vzniká pôsobením vzdušného kyslíka, vody na látky alebo zo vzájomného pôsobenia látok. Naolejované handry, kombinézy, vata a dokonca aj kovové hobliny sa samovoľne vznietia. Príčinou samovznietenia naolejovaných vláknitých materiálov je rozloženie tukových látok v tenkej vrstve na ich povrchu a absorpcia kyslíka zo vzduchu. Oxidácia oleja je sprevádzaná uvoľňovaním tepla. Ak sa generuje viac tepla, ako je strata tepla do okolia, potom môže dôjsť k spaľovaniu bez akéhokoľvek prívodu tepla. Niektoré látky sa pri interakcii s vodou spontánne vznietia. Patria sem draslík, sodík, karbid vápnika a karbidy alkalických kovov. Vápnik sa pri vystavení horúcej vode vznieti. Oxid vápenatý (nehasené vápno) sa pri interakcii s malým množstvom vody stáva veľmi horúcim a môže zapáliť horľavé materiály, ktoré sú s ním v kontakte (napríklad drevo). Niektoré látky sa po zmiešaní s inými spontánne vznietia. Patria sem predovšetkým silné oxidačné činidlá (chlór, bróm, fluór, jód), ktoré pri kontakte s niektorými organickými látkami spôsobujú ich samovznietenie. Acetylén, vodík, metán, etylén, terpentín sa pôsobením chlóru na svetle samovoľne vznietia. Kyselina dusičná, ktorá je tiež silným oxidačným činidlom, môže spôsobiť samovznietenie drevených hoblín, slamy a bavlny. Mikrobiologické samovznietenie spočíva v tom, že pri vhodnej vlhkosti a teplote v rastlinných produktoch rašelina zintenzívňuje životnú aktivitu mikroorganizmov. To zvyšuje teplotu a môže spôsobiť proces horenia. Tepelné samovznietenie vzniká v dôsledku dlhšieho pôsobenia nevýznamného zdroja tepla. V tomto prípade sa látky rozkladajú a v dôsledku zvýšených oxidačných procesov sa samovoľne zahrievajú. Polovysychavé rastlinné oleje (slnečnicový, bavlníkový atď.), ricínový olej, terpentínové laky, farby a základné nátery, drevo a drevovláknité dosky, strešný papier, nitrolinoleum a niektoré ďalšie materiály a látky sa môžu samovoľne vznietiť pri teplote okolia 80 - 100 ° C.
Samovznietenie Ide o samovznietenie sprevádzané objavením sa plameňa. Pevné a kvapalné látky, pary, plyny a prach zmiešané so vzduchom sa môžu samovoľne vznietiť.
Výbuch (výbušné spaľovanie) je extrémne rýchle horenie, ktoré je sprevádzané uvoľňovaním veľkého množstva energie a tvorbou stlačených plynov schopných spôsobiť mechanickú deštrukciu.
Typy spaľovania sa vyznačujú teplotnými parametrami, hlavné sú nasledujúce. Bod vzplanutia - je to najnižšia teplota horľavej látky, pri ktorej sa nad jej povrchom tvoria pary alebo plyny, ktoré sa môžu krátkodobo vznietiť vo vzduchu zo zdroja vznietenia. Rýchlosť tvorby pár alebo plynov je však stále nedostatočná na pokračovanie spaľovania. Bod vzplanutia - je to najnižšia teplota horľavej látky, pri ktorej sa z nej uvoľňujú horľavé pary alebo plyny takou rýchlosťou, že po ich zapálení od zápalného zdroja dôjde k stabilnému horeniu. Teplota automatického zapaľovania - je to najnižšia teplota látky, pri ktorej dochádza k prudkému zvýšeniu rýchlosti exotermických reakcií končiacich vznietením. Teplota samovznietenia skúmaných pevných horľavých materiálov a látok je 30 - 670 °C. Najnižšiu teplotu samovznietenia má biely fosfor a najvyššiu horčík. Pre väčšinu druhov dreva je táto teplota 330 - 470?
Zhrnutie bezpečnosti života
Téma 3. CHEMICKÉ ZÁKLADY SPAĽOVANIA.
3.1. Chémia spaľovacích reakcií.
Ako ste už pochopili, horenie je rýchla chemická reakcia sprevádzaná uvoľňovaním tepla a žiary (plameň). Zvyčajne ide o exotermickú oxidačnú reakciu kombinácie horľavej látky s oxidačným činidlom - vzdušným kyslíkom.
horľavých látok môžu byť plyny, kvapaliny a pevné látky-la. Sú to H 2, CO, síra, fosfor, kovy, C m H n (uhľovodíky vo forme plynov, kvapalín a pevných látok, t. j. organické látky. Prírodné uhľovodíky sú napr. zemný plyn, ropa, uhlie). V zásade môžu byť horľavé všetky látky schopné oxidácie.
Oxidačné činidlá slúžia: kyslík, ozón, halogény (F, Cl, Br, J), oxid dusný (NO 2), dusičnan amónny (NH 4 NO 3) atď. V kovoch môžu byť aj CO 2, H 2 O, N 2 oxidačné činidlá.
V niektorých prípadoch dochádza k horeniu počas rozkladných reakcií látok získaných v endotermických procesoch. Napríklad, keď sa acetylén rozpadne:
C2H2 \u003d 2C + H2.
exotermický Reakcie sú reakcie, pri ktorých sa uvoľňuje teplo.
Endotermický Reakcie sú reakcie, ktoré prebiehajú pri absorpcii tepla.
Napríklad:
2H2 + O2 \u003d 2H20 + Q - exotermická reakcia,
2H20 + Q \u003d 2H2 + O2 - endotermická reakcia,
kde: Q - tepelná energia.
Endotermické reakcie teda môžu prebiehať len so zavedením vonkajšej tepelnej energie, t.j. pri zahriatí.
Pri chemických reakciách sa podľa zákona o zachovaní hmotnosti hmotnosť látok pred reakciou rovná hmotnosti látok vzniknutých po reakcii. Pri vyrovnávaní chemických rovníc dostaneme stechiometrická formulácie.
Napríklad v reakcii
CH4 + 202 \u003d CO2 + 2H20
máme 1 mol CH 4 + 2 mol O 2 = 1 mol CO 2 + 2 mol H 2 O.
Počet mólov pred vzorcami látok sa nazýva stechiometrické koeficienty.
Ak vezmeme do úvahy pojmy „molárny objem“, „molárna koncentrácia“, „parciálny tlak“, zistíme, že na úplnú reakciu metánu sa musí 1 mol CH4 zmiešať s 2 molmi O2 alebo 1/3 \u003d 33,3 % CH4 a 2/3 = 66,7 % O2. Takéto zloženie sa nazýva stechiometrické.
Ak uvažujeme spaľovanie CH 4 na vzduchu, t.j. v zmesi 21% O2 + 79% N2 alebo O2 + 79 / 21N2 alebo O2 + 3,76N2, potom bude reakcia napísaná takto:
CH4 + 202 + 2 x 3,76 N2 \u003d CO2 + 2H20 + 2 x 3,76 N 2.
1 mol CH4+2 mol O2 +7,52 mol N2 \u003d 10,52 mol zmesi O2, N2 a CH4.
Potom bude stechiometrické zloženie zmesi:
(1/10,52) x 100 % = 9,5 % CH4; (2/10,52) x 100 % = 19,0 % 02;
(7,52 / 10,52) * 100 % \u003d 71,5 % N 2.
To znamená, že v najhorľavejšej zmesi bude namiesto 100 % (CH 4 + O 2) v reakcii s kyslíkom 24 % (CH 4 + O 2) v reakcii so vzduchom, t.j. sa uvoľní oveľa menej tepla.
Rovnaký obraz získame, ak zmiešame ľubovoľné, nestechiometrické kompozície.
Napríklad v reakcii 2CH4 + 2O2 \u003d CO2 + 2H20 + CH4 1 mol CH4 neproreaguje.
V reakcii CH 4 + 4O 2 \u003d CO 2 + 2H20 + 2O2 2 móly O 2 sa nezúčastňujú reakcie, ale zohrávajú úlohu balastu, ktorý vyžaduje určité množstvo tepla na ich ohrev.
Ak teda porovnáme spaľovacie reakcie metánu v kyslíku a vzduchu alebo v prebytku CH 4 a O 2, potom je zrejmé, že množstvo tepla uvoľneného pri prvej reakcii bude väčšie ako pri ostatných, pretože v nich:
Menšie koncentrácie reaktantov v celkovej zmesi;
Časť tepla sa spotrebuje na ohrev balastu: dusík, kyslík alebo metán.
Položme si otázky:
Aká energia sa môže uvoľniť pri reakcii?
Čo určuje množstvo tepla, t.j. tepelný efekt re-
Koľko tepelnej energie treba pridať
endotermická reakcia?
Na tento účel sa zavádza pojem tepelný obsah látky.
3.2 Výhrevnosť látok.
Odkiaľ sa vzalo teplo pri reakcii spaľovania metánu? Takže bol skrytý v molekulách CH 4 a O 2 a teraz bol uvoľnený.
Tu je príklad jednoduchšej reakcie:
2H2+02 \u003d 2H20 + Q
To znamená, že hladina energie stechiometrickej zmesi vodíka a kyslíka bola vyššia ako hladina reakčného produktu H2O a z látky sa uvoľnila „extra“ energia.
Pri reverznej reakcii elektrolýzy vody, t.j. rozkladom vody za pomoci elektrickej energie dochádza k redistribúcii atómov v molekule vody za vzniku vodíka a kyslíka. V tomto prípade sa tepelný obsah H 2 a O 2 zvyšuje.
Každá látka teda počas svojho vzniku prijíma alebo odovzdáva určitú energiu a miera tepelnej energie akumulovanej látkou počas jej vzniku sa nazýva tepelný obsah, alebo entalpia.
Na rozdiel od chémie sa v chemickej termodynamike teplo vzniku látky neoznačuje symbolom Q, ale symbolom DH so znamienkom (+), ak je teplo absorbované chemickou zlúčeninou, a znamienkom (-) ak sa teplo počas reakcie uvoľní, to znamená, že „odíde“ zo systémov.
Označuje sa štandardné teplo vzniku 1 mólu látky pri tlaku 101,3 kPa a teplote 298 K.
Referenčné knihy uvádzajú teplo tvorby zlúčenín z jednoduchých látok.
Napríklad:
Pri CO 2 \u003d - 393,5 kJ / mol
U H2O plyn \u003d - 241,8 kJ / mol
Ale pre látky vytvorené počas endotermických procesov, napríklad acetylén C2H2 \u003d + 226,8 kJ / mol, počas tvorby atómu vodíka H + podľa reakcie H2 \u003d H + + H + \u003d + 217,9 kJ/mol.
Pre čisté látky pozostávajúce z jedného chemického prvku v stabilnej forme (H 2 , O 2 , C, Na atď.) sa DH bežne považuje za rovné nule.
Ak však rozoberáme makroskopické vlastnosti látok, potom rozlišujeme niekoľko foriem energie: kinetickú, potenciálnu, chemickú, elektrickú, tepelnú, jadrovú energiu a mechanickú prácu. A ak zvážime problém na molekulárnej úrovni, potom tieto formy energie možno vysvetliť iba na základe dvoch foriem - kinetickej energie pohybu a potenciálnej pokojovej energie atómov a molekúl.
Pri chemických reakciách sa menia iba molekuly. Atómy zostávajú nezmenené. Molekulová energia je väzbová energia jeho atómov, nahromadená v molekule. Je určená vzájomnými príťažlivými silami atómov. Okrem toho existuje potenciálna energia príťažlivosti molekúl k sebe navzájom. Je malý v plynoch, vyšší v kvapalinách a ešte vyšší v pevných látkach.
Každý atóm má energiu, z ktorej časť je spojená s elektrónmi a časť - s jadrom. Elektróny majú kinetickú energiu rotácie okolo jadra a potenciálnu elektrickú energiu vzájomnej príťažlivosti a odpudzovania.
Súčet týchto foriem molekulárnej energie je tepelný obsah molekuly.
Ak spočítame tepelný obsah 6,02×10 23 molekúl látky, dostaneme molárny tepelný obsah tejto látky.
Prečo sa tepelný obsah jednoprvkových látok (molekúl jedného prvku) berie ako nula, je možné vysvetliť nasledovne.
DH chemického prvku, teda energia jeho vzniku, je spojená s vnútrojadrovými procesmi. Jadrová energia je spojená so silami interakcie vnútrojadrových častíc a premenou jedného chemického prvku na iný počas jadrových reakcií. Napríklad rozkladová reakcia uránu:
alebo jednoduchšie: U+n®Ba+Kr+3n.
kde: n ’ o je neutrónová častica s hmotnosťou 1 a nulovým nábojom.
Urán zachytí neutrón, v dôsledku čoho sa rozštiepi (rozpadne) na dva nové prvky - bárium a kryptón - za vzniku 3 neutrónov a uvoľní sa jadrová energia.
Treba povedať, že s jadrovými reakciami sú spojené miliónkrát väčšie energetické zmeny ako s chemickými reakciami. Energia rozpadu uránu je teda 4,5×109 kcal/mol×urán. To je 10 miliónov krát viac, ako keď sa spáli jeden mól uhlia.
Pri chemických reakciách sa atómy nemenia, ale molekuly áno. Preto sa energia tvorby atómov chemikmi neberie do úvahy a DH jednoprvkových molekúl plynu a atómov čistých látok sa rovná nule.
Vyššie uvedená reakcia rozpadu uránu je klasickým príkladom reťazovej reakcie. Teóriu reťazového mechanizmu spaľovacej reakcie zvážime neskôr. Ale odkiaľ neutrón pochádza a čo spôsobuje, že reaguje s uránom - je to spôsobené takzvanou aktivačnou energiou, o ktorej budeme uvažovať o niečo neskôr.
3.3. Tepelný účinok reakcie.
Fakt, že každá jednotlivá látka obsahuje určité množstvo energie, slúži ako vysvetlenie tepelných účinkov chemických reakcií.
Podľa Hessovho zákona: Tepelný účinok chemickej reakcie závisí len od charakteru počiatočných a konečných produktov a nezávisí od počtu medzireakcií prechodu z jedného stavu do druhého.
Dôsledok 1 tohto zákona: Tepelný účinok chemickej reakcie sa rovná rozdielu medzi súčtom teplôt tvorby konečných produktov a súčtom teplôt tvorby teplôt východiskových látok, berúc do úvahy koeficienty vo vzorcoch tieto látky v reakčnej rovnici.
Napríklad pri reakcii 2H2+02 \u003d 2H20 ± DH.
![]() ;
; ![]() ; .
; .
V dôsledku toho bude všeobecná reakčná rovnica vyzerať takto:
2H2 + O2 \u003d 2H20 - 582 kJ / mol.
A ak je DH znamienko (-), potom je reakcia exotermická.
Dôsledok 2. Podľa Lavoisierovho-Laplaceovho zákona je tepelný účinok rozkladu chemickej zlúčeniny rovnaký a opačný v znamienku ako tepelný účinok jej vzniku.
Potom bude reakcia rozkladu vody:
2H20 \u003d 2H2 + O2 +582 kJ / mol, t.j. táto reakcia je endotermická.
Príklad zložitejšej reakcie:
CH4 + 202 \u003d CO2 + 2H20.
Potom bude reakcia napísaná takto:
CH 4 + 2O 2 \u003d CO 2 + 2H 2 O - 742,3 kJ / mol, čo znamená, že reakcia je exotermická.
3.4. Kinetické základy reakcií plynov.
Podľa zákona o pôsobení hmoty je rýchlosť reakcie pri konštantnej teplote úmerná koncentrácii reagujúcich látok alebo, ako sa hovorí, „pôsobiacich hmôt“.
Rýchlosť chemickej reakcie ( υ ) je obvyklé brať do úvahy množstvo látky reagujúcej za jednotku času ( dt) na jednotku objemu ( dV).
Zvážte priebeh reakcie podľa rovnice:
A + B = C + D.
Pretože rýchlosť reakcie charakterizuje pokles koncentrácie reaktantov s časom a zvýšenie koncentrácie reakčných produktov, môžeme napísať:
![]() , (3.1)
, (3.1)
kde mínusy pri derivátoch označujú smer zmeny koncentrácie zložiek a koncentrácie zložiek sú uvedené v hranatých zátvorkách.
Potom prebieha priama ireverzibilná reakcia pri T \u003d const rýchlosťou:
![]() , (3.2)
, (3.2)
kde: k je rýchlostná konštanta chemickej reakcie. Nezávisí od koncentrácie zložiek, ale mení sa iba s teplotou.
Podľa zákona o pôsobení hmoty sú koncentrácie reakčných zložiek zahrnuté do kinetickej rovnice v miere rovnej stechiometrickému koeficientu tejto zložky.
Takže k reakcii
aA + bB = cC + dD
Kinetická rovnica má tvar:
Exponenty a, b, c, d sa zvyčajne nazývajú poradie reakcií pre zložky A, B, C, D a súčet exponentov sa nazýva všeobecný poriadok reakcie.
Napríklad reakcie ako
A ® bB + cC - objednávam,
2A \u003d bB + cC - poradie II,
A + B \u003d cC + dD - III poradie.
Keďže koncentrácie všetkých reagujúcich zložiek sú vzájomne prepojené stechiometrickými rovnicami, najjednoduchšie kinetické rovnice prvého rádu sú diferenciálne rovnice prvého rádu s jednou nezávislou premennou – koncentráciou – a možno ich integrovať.
Najjednoduchšia kinetická rovnica je rovnica prvého poriadku tohto typu
pre ktoré ![]() . (3.4)
. (3.4)
Označme koncentráciou zložky A pred začiatkom reakcie a integráciou rovnice za okrajovej podmienky t=0, [A]=[A 0 ] dostaneme:
Alebo [A]=×e - kt . (3,5)
Závislosť rýchlosti reakcie od koncentrácie látok je teda exponenciálna.
Kinetická energia plynov to vysvetľuje takto. Podľa Arrheniovej hypotézy reakcia medzi molekulami prebieha len vtedy, ak sú aktívne, t.j. majú nadbytočnú energiu dostatočnú na prerušenie medziatómových väzieb, takzvanú aktivačnú energiu E A.
Tie. rýchlosť chemickej reakcie nezávisí od počtu zrážok všetkých molekúl, ale iba aktivovaných.
Podľa Boltzmannovho zákona počet aktívnych molekúl
n A \u003d n o * e - E / RT, (3.6)
kde: E je aktivačná energia,
T je teplota zmesi plynov,
n o je celkový počet molekúl.
Potom sa počet efektívnych zrážok, ktorý sa zhoduje s rýchlosťou reakcie, rovná:
υ p \u003d Z eff \u003d Z 0 * e - E / RT, (3,7)
kde: Z 0 je celkový počet molekulárnych zrážok.
1) reakčná rýchlosť je úmerná koncentrácii aktívnych molekúl, ktorých počet závisí od teploty a tlaku v zmesi, pretože tlak je počet molekúl, ktoré sa zrážajú s akýmkoľvek povrchom;
2) reakcia je možná len vtedy, ak interagujúce molekuly dostanú určité množstvo energie dostatočné na prerušenie alebo oslabenie medziatómových väzieb. Aktivácia spočíva v prechode molekúl do stavu, v ktorom je možná chemická transformácia.
Najčastejšie proces aktivácie prebieha tvorbou intermediárnych, nestabilných, ale vysoko aktívnych zlúčenín atómov.
Nielen pre vznik endotermických procesov je teda potrebný vonkajší prísun energie, ale aj pre exotermické. Aby došlo k exotermickej reakcii, musí sa jej odovzdať určitý impulz tepelnej energie. Napríklad, aby došlo k spaľovacej reakcii v zmesi vodíka a kyslíka, musí sa zapáliť.
Minimálne množstvo tepelnej energie potrebné na „spustenie“ chemickej reakcie sa nazýva aktivačná energia.
3.5. Energia aktivácie reakcie.
Na vysvetlenie tohto javu sa často používa nasledujúci príklad (obr. 9):
Na plošine je lopta. Lokalita sa nachádza pred kopcom. Preto by sa loptička mohla kotúľať aj sama, nebyť sklzu. Ale pre spontánny zjazd sa musí zdvihnúť na vrchol kopca. V tomto prípade sa uvoľní nielen energia stúpania do kopca, ale aj zjazdu.

Ryža. 9. Schéma aktivácie reakcie.
Zvážte dve reakcie:
1) H2 + O2 \u003d H20-
2) H20 \u003d H2+02+
Ako je možné vidieť z obrázku, E2 = + Ei;
Vo všeobecnosti pre akúkoľvek reakciu
![]() .
.
A znamienko tepelného efektu závisí od rozdielu medzi E 1 a E 2, ktoré sú vždy kladné.
Aktivačná energia je teda energia potrebná na premenu reagujúcich látok do stavu aktívneho komplexu (rozbíjanie medziatómových väzieb, spájanie molekúl, akumulácia energie v molekule ...).
So zvyšujúcou sa teplotou plynov sa prudko zvyšuje podiel aktívnych molekúl (e - E / RT), a tým aj rýchlosť reakcie podľa exponenciálnej závislosti. Túto závislosť možno znázorniť takto:

Ryža. 10. Závislosť rýchlosti reakcie od teploty: 1 - rýchlosť 1. reakcie, 2 - rýchlosť 2. reakcie.
Ako je možné vidieť na obrázku 10, rýchlosť prvej reakcie je menšia ako rýchlosť druhej reakcie a aktivačná energia prvej reakcie je väčšia ako E druhej reakcie. A pri rovnakej teplote T2 υ 2 > υ 1 . Čím vyššia je aktivačná energia, tým vyššia je teplota potrebná na dosiahnutie danej rýchlosti reakcie.
Dôvodom je, že keď je E väčšie, potom sú existujúce medziatómové väzby v molekulách reagujúcich zložiek silnejšie a na prekonanie týchto síl je potrebné viac energie. V tomto prípade je podiel aktívnych molekúl zodpovedajúcim spôsobom nižší.
Z vyššie uvedeného je zrejmé, že veľkosť aktivačnej energie je najdôležitejšou charakteristikou chemického procesu. Určuje výšku energetickej bariéry, ktorej prekonanie je podmienkou pre priebeh reakcie. Na druhej strane charakterizuje rýchlosť reakcie ako funkciu teploty, t.j. čím vyššia je aktivačná energia, tým vyššia je teplota na dosiahnutie danej reakcie.
3.6. Katalýza.
Okrem zvýšenia teploty a koncentrácie látok na urýchlenie chemickej reakcie využívajú katalyzátory, t.j. látky, ktoré sa do reakčnej zmesi zavedú, ale pri reakcii sa nespotrebujú, ale zrýchlia ju znížením aktivačnej energie.
Proces zvyšovania rýchlosti reakcie pomocou katalyzátorov sa nazýva katalýza.
Katalyzátory sa podieľajú na medzireakciách vytvárania aktivovaného komplexu oslabením väzieb v molekulách východiskových látok, ich rozkladom, adsorpciou molekúl na povrchu katalyzátora alebo zavedením aktívnych častíc katalyzátora.
Charakter účasti katalyzátora možno vysvetliť nasledujúcou schémou:
Reakcia bez katalyzátora: A + B = AB.
S katalyzátorom X: A + X = AX® AX + B = AB + X.
Uvádzame obrázok podobný tomu, ktorý je znázornený na obr. 9.

Ryža. 11. Schéma pôsobenia katalyzátora: E b.kat a E s kat sú aktivačné energie reakcie bez katalyzátora a s katalyzátorom.
Keď sa zavedie katalyzátor (obr. 11), reakcia môže prebiehať inou cestou s nižšou energetickou bariérou. Táto dráha zodpovedá novému reakčnému mechanizmu prostredníctvom tvorby ďalšieho aktivovaného komplexu. A nová nižšia energetická bariéra môže prekonať viac častíc, čo vedie k zvýšeniu rýchlosti reakcie.
Treba si uvedomiť, že aktivačná energia reverznej reakcie klesá o rovnakú hodnotu ako aktivačná energia priamej reakcie, t.j. obe reakcie sa zrýchľujú rovnako a katalyzátory reakciu nespúšťajú, iba urýchľujú reakciu, ktorá môže prebiehať aj v ich neprítomnosti, ale oveľa pomalšie.
Medziprodukty reakcie sa môžu stať katalyzátormi, potom sa táto reakcia nazýva autokatalytická. Takže ak rýchlosť bežných reakcií klesá, keď sa reaktanty spotrebúvajú, potom sa spaľovacia reakcia v dôsledku autokatalýzy samovoľne zrýchľuje a je autokatalytická.
Najčastejšie sa ako katalyzátory používajú pevné látky, ktoré adsorbujú molekuly reaktantov. Pri adsorpcii dochádza k oslabeniu väzieb v reagujúcich molekulách, a tým k uľahčeniu reakcie medzi nimi.
Čo je adsorpcia?
3.7. Adsorpcia.
Adsorpcia- povrchová absorpcia látky z plynného prostredia alebo roztoku povrchovou vrstvou inej látky - kvapaliny alebo tuhej látky.
Napríklad adsorpcia toxických plynov na povrchu aktívneho uhlia používaného v plynových maskách.
Rozlišujte medzi fyzikálnou a chemickou adsorpciou.
O fyzické adsorpciou si zachytené častice zachovajú svoje vlastnosti a kedy chemický– vznikajú chemické zlúčeniny adsorbátu s adsorbentom.
Proces adsorpcie je sprevádzaný uvoľňovaním tepla. Pre fyzikálnu adsorpciu je nevýznamná (1-5 kcal/mol), pre chemickú adsorpciu je oveľa vyššia (10-100 kcal/mol). Chemické reakcie počas katalýzy sa tak môžu urýchliť.
Pre procesy spaľovania a výbuchu možno uviesť tieto príklady:
1. Teplota samovznietenia zmesi H 2 + O 2 je 500 0 C. V prítomnosti paládiového katalyzátora klesá na 100 0 C.
2. Procesy samovznietenia uhlia začínajú chemickou adsorpciou kyslíka na povrchu častíc uhlia.
3. Pri práci s čistým kyslíkom sa kyslík dobre adsorbuje na odevoch (fyzikálna adsorpcia). A v prítomnosti iskry alebo plameňa sa oblečenie ľahko rozhorí.
4. Kyslík sa dobre adsorbuje a absorbuje technickými olejmi za vzniku výbušnej zmesi. Zmes vybuchne spontánne, bez zdroja vznietenia (chemická absorpcia).
Takmer každý deň sa všetci musíme potýkať s tým či oným prejavom spaľovacieho procesu. V našom článku chceme podrobnejšie povedať, aké vlastnosti tento proces zahŕňa z vedeckého hľadiska.
Je hlavnou zložkou požiarneho procesu. Požiar začína začiatkom horenia, jeho intenzita rozvoja je zvyčajne dráha, ktorú oheň prejde, teda rýchlosť horenia, a uhasenie končí zastavením horenia.
Horenie sa zvyčajne chápe ako exotermická reakcia medzi palivom a oxidačným činidlom, sprevádzaná aspoň jedným z nasledujúcich troch faktorov: plameň, žiara, tvorba dymu. Vzhľadom na zložitosť procesu spaľovania nie je táto definícia vyčerpávajúca. Neberie do úvahy také dôležité vlastnosti spaľovania, ako je rýchly tok základnej exotermickej reakcie, jej autonómny charakter a schopnosť samošírenia procesu cez horľavú zmes.
Rozdiel medzi pomalou exotermickou oxidačno-redukčnou reakciou (korózia železa, hniloba) a spaľovaním je v tom, že horenie prebieha tak rýchlo, že teplo vzniká rýchlejšie, ako sa rozptýli. To vedie k zvýšeniu teploty v reakčnej zóne o stovky až tisíce stupňov, k viditeľnému žiareniu a vzniku plameňa. V skutočnosti takto vzniká ohnivé spaľovanie.Ak sa uvoľňuje teplo, ale nie je plameň, potom sa tento proces nazýva tlenie.Pri oboch procesoch dochádza k aerosólom úplného alebo neúplného spaľovania látok. Stojí za zmienku, že počas spaľovania niektorých látok nie je plameň viditeľný a nedochádza ani k emisii dymu, medzi takéto látky patrí vodík. Príliš rýchle reakcie (výbušná premena) tiež nie sú zahrnuté do pojmu horenie.
Nevyhnutnou podmienkou pre vznik horenia je prítomnosť horľavej látky, oxidačného činidla (pri požiari zohráva úlohu kyslík vo vzduchu) a zdroja vznietenia. Pre priame zapálenie musia existovať kritické podmienky pre zloženie horľavej zmesi, geometriu a teplotu horľavého materiálu, tlak atď. Po začiatku horenia pôsobí ako zdroj vznietenia samotný plameň alebo reakčná zóna.
Napríklad metán je schopný oxidovať kyslíkom za uvoľnenia tepla na metylalkohol a kyselinu mravčiu pri 500-700 K. Aby však reakcia pokračovala, musí sa vďaka vonkajšiemu ohrevu doplniť teplo. Nie je to spaľovanie. Pri zahriatí reakčnej zmesi na teplotu nad 1000 K sa rýchlosť oxidácie metánu zvýši natoľko, že uvoľnené teplo postačuje na ďalšie pokračovanie reakcie, zmizne potreba prívodu tepla zvonku a začne sa horenie. Vzniknutá spaľovacia reakcia je teda schopná sa sama podporovať. Toto je hlavný rozlišovací znak spaľovacieho procesu. Ďalšou vlastnosťou, ktorá je s tým spojená, je schopnosť plameňa, ktorý je zónou chemickej reakcie, spontánne sa šíriť cez horľavé médium alebo horľavý materiál rýchlosťou určenou povahou a zložením reakčnej zmesi, ako aj podmienkami procesu. . Toto je hlavný mechanizmus vzniku požiaru.
Typický model spaľovania je založený na oxidačnej reakcii organických látok alebo uhlíka so vzdušným kyslíkom. Spaľovanie sprevádza mnoho fyzikálnych a chemických procesov. Fyzika je prenos tepla do systému. Oxidačné a redukčné reakcie sú zo strany chémie súčasťou povahy spaľovania. Z koncepcie spaľovania teda vyplývajú rôzne chemické premeny, vrátane rozkladu východiskových zlúčenín, disociácie a ionizácie produktov.
Kombinácia horľavej látky alebo materiálu s oxidačným činidlom je horľavé médium. V dôsledku rozkladu horľavých látok pod vplyvom zápalného zdroja vzniká reakčná zmes plyn-para-vzduch. Horľavé zmesi, ktoré svojim zložením (pomerom zložiek paliva a okysličovadla) zodpovedajú rovnici chemickej reakcie, sa nazývajú zmesi stechiometrického zloženia. Sú najnebezpečnejšie z hľadiska požiaru: ľahšie sa zapália, horia intenzívnejšie, zabezpečujú úplné spálenie látky, v dôsledku čoho uvoľňujú maximálne množstvo tepla.
Ryža. 1. Tvary difúznych plameňov
a - prúdové spaľovanie, b - spaľovanie rozliatej kvapaliny, c - spaľovanie lesného odpadu
Podľa pomeru množstva horľavého materiálu a objemu okysličovadla sa rozlišujú chudobné a bohaté zmesi: chudobné zmesi obsahujú nadbytok okysličovadla, bohaté obsahujú horľavý materiál. Minimálne množstvo oxidačného činidla potrebné na úplné spálenie jednotkovej hmotnosti (objemu) konkrétnej horľavej látky je určené rovnicou chemickej reakcie. Pri horení za účasti kyslíka je požadovaná (merná) spotreba vzduchu pre väčšinu horľavých látok v rozmedzí 4-15 m 3 /kg. Spaľovanie látok a materiálov je možné len vtedy, ak je obsah ich pár alebo plynných produktov vo vzduchu, ako aj pri koncentrácii kyslíka nie nižšej ako daný limit.
Takže u kartónu a bavlny dochádza k samozhášaniu už pri 14 obj. kyslíka a polyesterovej vlny - pri 16 obj. %. V procese spaľovania, ako aj pri iných chemických procesoch, sú povinné dva stupne: vytvorenie molekulárneho kontaktu medzi reaktantmi a samotná interakcia molekúl paliva s oxidačným činidlom za vzniku reakčných produktov. Ak je rýchlosť konverzie počiatočných činidiel určená difúznymi procesmi, t.j. rýchlosť prenosu (výpary horľavých plynov a kyslíka sa v dôsledku koncentračného gradientu prenášajú do reakčnej zóny v súlade s Fickovými zákonmi difúzie), potom sa tento režim horenia nazýva difúzia. Na obr. 1 sú znázornené rôzne formy difúznych plameňov. V difúznom režime je spaľovacia zóna rozmazaná a vytvára sa v nej značné množstvo produktov nedokonalého spaľovania. Ak rýchlosť horenia závisí iba od rýchlosti chemickej reakcie, ktorá je oveľa vyššia ako rýchlosť difúzie, potom sa režim horenia nazýva kinetický. Vyznačuje sa vyššími rýchlosťami a úplnosťou spaľovania a v dôsledku toho vysokou rýchlosťou uvoľňovania tepla a teplotou plameňa. Tento režim prebieha v predmiešaných zmesiach paliva a okysličovadla. Ak sú teda činidlá v zóne chemickej reakcie v rovnakej (zvyčajne plynnej) fáze, potom sa takéto spaľovanie nazýva homogénne, keď sú palivo a okysličovadlo v reakčnej zóne v rôznych fázach, nazýva sa heterogénne. Homogénne je spaľovanie nielen plynov, ale aj väčšiny tuhých látok. Vysvetľuje to skutočnosť, že v reakčnej zóne nehoria samotné materiály, ale ich pary a plynné produkty rozkladu. Prítomnosť plameňa je znakom homogénneho spaľovania.
Príkladom heterogénneho spaľovania je spaľovanie uhlíka, uhlíkatých zvyškov dreva, neprchavých kovov, ktoré zostávajú v pevnom stave aj pri vysokých teplotách. K chemickej reakcii horenia v tomto prípade dôjde na rozhraní (tuhé a plynné). Upozorňujeme, že konečnými produktmi spaľovania môžu byť nielen oxidy, ale aj fluoridy, chloridy, nitridy, sulfidy, karbidy atď.
Charakteristiky spaľovacieho procesu sú rôzne. Možno ich rozdeliť do nasledujúcich skupín: tvar, veľkosť a štruktúra plameňa; teplota plameňa, jeho emisivita; uvoľňovanie tepla a teplo spaľovania; rýchlosť spaľovania a koncentračné limity trvalo udržateľného spaľovania atď.
Každý vie, že počas spaľovania sa vytvára žiara, ktorá sprevádza produkt spaľovania.
Zvážte dva systémy:
- plynný systém
- kondenzovaný systém
V prvom prípade, keď dôjde k horeniu, bude celý proces prebiehať v plameni, zatiaľ čo v druhom prípade bude časť reakcií prebiehať v samotnom materiáli alebo na jeho povrchu. Ako už bolo spomenuté vyššie, existujú plyny, ktoré môžu horieť bez plameňa, ale ak vezmeme do úvahy pevné látky, existujú aj skupiny kovov, ktoré sú tiež schopné horieť bez vyvinutia plameňa.
Časť plameňa s maximálnou hodnotou, kde dochádza k intenzívnym premenám, sa nazýva čelo plameňa.
Procesy výmeny tepla a difúzie aktívnych častíc zo spaľovacej zóny, ktoré sú kľúčovými mechanizmami pohybu čela plameňa cez horľavú zmes.
Rýchlosť šírenia plameňa sa zvyčajne delí na:
- deflagrácia (normálna), prúdiaca podzvukovou rýchlosťou (0,05-50 m/s)
- detonácia, kedy rýchlosti dosahujú 500-3000 m/s.

Ryža. 2. Laminárny difúzny plameň
V závislosti od povahy rýchlosti prúdu plynu, ktorý vytvára plameň, sa rozlišujú laminárne a turbulentné plamene. V laminárnom plameni dochádza k pohybu plynov v rôznych vrstvách, všetky procesy prenosu tepla a hmoty prebiehajú molekulárnou difúziou a konvekciou. V turbulentných plameňoch sa procesy prenosu tepla a hmoty uskutočňujú najmä v dôsledku makroskopického vírivého pohybu. Plameň sviečky je príkladom laminárneho difúzneho plameňa (obrázok 2). Akýkoľvek plameň vyšší ako 30 cm už bude mať náhodnú plynnú mechanickú nestabilitu, ktorá sa prejavuje viditeľným vírením dymu a plameňa.

Ryža. 3. Prechod z laminárneho na turbulentné prúdenie
Veľmi jasným príkladom prechodu z laminárneho na turbulentné prúdenie je obláčik cigaretového dymu (obr. 3), ktorý po vystúpení do výšky asi 30 cm nadobúda turbulencie.
Pri požiaroch majú plamene difúzny turbulentný charakter. Prítomnosť turbulencie v plameni zvyšuje prenos tepla a miešanie ovplyvňuje chemické procesy. V turbulentnom plameni je aj rýchlosť horenia vyššia. Tento jav sťažuje prenos správania malých plameňov na veľké plamene s veľkou hĺbkou a výškou.
Experimentálne bolo dokázané, že teplota spaľovania látok vo vzduchu je oveľa nižšia ako teplota spaľovania v atmosférickom kyslíkovom prostredí.
Vo vzduchu bude teplota kolísať od 650 do 3100 °C a v kyslíku sa teplota zvýši o 500-800 °C.
- Deadpool - Riešenie problémov
- Nezačneme Ako prežiť?
- Čo robiť, ak sa bioshock infinite nespustí
- Návod Nancy Drew: Alibi in Ashes
- Spec Ops: The Line - recenzia hry, recenzia Spec ops linka padá pri misiách
- Návod na únik z miestnosti 1. úrovne
- Spracovanie paradajok s kyselinou boritou Koľko budú 2 gramy kyseliny boritej
- Uhorková tráva (Borago)
- Bioinsekticíd Lepidocid: účel, vlastnosti a postup aplikácie Čakacia doba lepidocidu
- ako zmeniť jazyk na ruštinu v steame
- Dendrobium noble: izbová starostlivosť
- Morfológia rastlín všeobecné pojmy - dokument
- Výsadba, rozmnožovanie a starostlivosť o bambus doma, foto Pestovanie bambusu zo semien
- Ako posilniť mobilný signál pre internet v krajine
- Sanskrit odhaľuje zabudnutý význam ruských slov (2 fotografie)
- Najstarší jazyk sanskrt programovací jazyk budúcnosti mŕtvy jazyk sanskrt
- Kto má nadvládu nad celou zemou?
- Symboly a amulety slobodomurárov Slávny slobodomurársky amulet za peniaze
- Hekatein otec. Temné bohyne. Pôvod a genealógia
- flotila severských veterných aerolínií