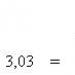Prezentacija iz fizike na temu: "Spektri. Vrste spektara
Spektralni sastav zračenja atoma raznih tvari vrlo je raznolik. Ipak, svi se spektri mogu podijeliti u tri vrlo različite vrste.
Kontinuirani (kontinuirani) spektri. Kontinuirani spektar zračenja (slika 4.12.1) sadrži valove svih valnih duljina. Nema praznina u spektru, a na ekranu spektrografa može se vidjeti kontinuirana raznobojna traka s glatkim prijelazom iz jedne boje u drugu.
Kontinuirani (ili kontinuirani) spektri daju tijela koja su u krutom ili tekućem stanju, kao i visoko komprimirane plinove. Da biste dobili kontinuirani spektar, morate zagrijati tijelo na visoku temperaturu. Priroda kontinuiranog spektra i sama činjenica njegovog postojanja određuju se ne samo svojstvima pojedinačnih atoma koji zrače, već također u velikoj mjeri ovise o međudjelovanju atoma s drugima. Kontinuirani spektar također proizvodi visokotemperaturna plazma. Elektromagnetske valove emitira plazma uglavnom kada se elektroni sudare s ionima.
Linijski spektri. Linijski emisijski spektri (sl. 4.12.2,3,4) su skup obojenih linija različite svjetline, odvojenih širokim tamnim prugama. Prisutnost linijskog spektra znači da tvar emitira svjetlost samo sasvim određenih valnih duljina (točnije, u određenim vrlo uskim spektralnim intervalima). Svaka od linija ima konačnu širinu. Linijski spektri daju sve tvari u plinovitom atomskom (ali ne i molekularnom) stanju. Izolirani atomi kemijskog elementa emitiraju strogo određene valne duljine karakteristične za određeni kemijski element. Priroda linijskih spektara objašnjava se činjenicom da atomi određene tvari imaju samo vlastita stacionarna stanja s vlastitim skupom energetskih razina.
Obično se linijski spektri promatraju pomoću sjaja para tvari u plamenu ili sjaja plinskog pražnjenja u cijevi ispunjenoj plinom koji se proučava. S povećanjem gustoće atomskog plina, pojedine spektralne linije se šire i, pri vrlo visokoj gustoći plina, kada interakcija atoma postane značajna, te se linije međusobno preklapaju, tvoreći kontinuirani spektar.
Prugasti spektri. Prugasti emisijski spektri sastoje se od pojedinačnih traka odvojenih tamnim prazninama (Slika 4.13 : a, b). Uz pomoć vrlo dobrog spektralnog instrumenta, može se ustanoviti da je svaki pojas skup velikog broja vrlo blisko razmaknutih linija. Za razliku od linijskih spektara, prugaste spektre ne proizvode atomi, već molekule koje nisu međusobno povezane ili su slabo povezane.
Apsorpcijski spektri. Ako se bijela svjetlost propusti kroz hladan plin koji ne zrači, tada se pojavljuju tamne apsorpcijske linije na pozadini kontinuiranog spektra izvora (slika 4.14). Plin najintenzivnije upija svjetlost upravo onih valnih duljina koje emitira kada je jako vruće. Tamne linije na pozadini kontinuiranog spektra su apsorpcijske linije, koje zajedno tvore apsorpcijski spektar. Apsorpcijski spektri mogu biti kontinuirani, prugasti i prugasti.
Atom, apsorbirajući svjetlost, prelazi iz osnovnog stanja u pobuđeno stanje, a za pobuđivanje atoma pogodni su strogo određeni kvanti energije koji odgovaraju danom plinu. Stoga plin apsorbira iz kontinuiranog spektra iste kvante svjetlosti koje može sam emitirati.
Slike 4.12 i 4.14 uspoređuju emisijske i apsorpcijske spektre razrijeđenih para natrija, vodika i helija. Proučavajući spektre emisije i apsorpcije atoma, fizičari su još u 19. stoljeću došli do zaključka da atom nije nedjeljiva čestica, već ima neku unutarnju složenu strukturu.
U osnovi je uporaba linijskih spektara spektralna analiza - metoda za proučavanje kemijskog sastava tvari njihovim spektrima. Pojedinačne linije u spektrima raznih elemenata mogu se podudarati, ali općenito je spektar svakog elementa njegova individualna karakteristika. Spektralna analiza je odigrala veliku ulogu u znanosti. Na primjer, Fraunhoferove tamne linije otkrivene su u spektru Sunca (1814.), čije se podrijetlo objašnjava na sljedeći način. Sunce, kao vruća plinska lopta (T ~ 6000 °C), emitira kontinuirani spektar.
Sunčeve zrake prolaze kroz Sunčevu atmosferu (Sunčevu koronu, čija je temperatura ~2000-3000 °C. Korona apsorbira zračenje određene frekvencije iz kontinuiranog spektra, a Sunčev apsorpcijski spektar snima se na Zemlji (sl. 4.14.). .5), pomoću kojih je moguće odrediti koji su kemijski elementi prisutni u Sunčevoj koroni. Iz apsorpcijskih spektara na Suncu detektirani su svi zemaljski elementi, kao i dosad nepoznati element, koji je nazvan helij. 26 godina (1894.) na Zemlji je otkriven helij. Spektralnom analizom na Zemlji je otkriveno još 25 kemijskih elemenata.
Štoviše, spektralna analiza Sunca i zvijezda pokazala je da su kemijski elementi koji ulaze u njihov sastav prisutni i na Zemlji, tj. materija Svemira sastoji se od istog skupa elemenata. Zbog svoje relativno jednostavnosti i svestranosti, spektralna analiza je glavna metoda za praćenje sastava tvari u metalurgiji i strojarstvu. Uz pomoć spektralne analize kemijski sastav ruda i minerala određuje se i emisijskim i apsorpcijskim spektrima. Sastav složenih smjesa analizira se molekulskim spektrima. Pod određenim uvjetima, metodama spektralne analize može se odrediti ne samo kemijski sastav komponenti, već i njihov kvantitativni sadržaj.
Članak govori o definiciji i vrstama spektara, ističe područja primjene spektroskopije, a također opisuje proučavanje nepoznatog krutog tijela i vrste spektara koji se za to koriste.
Što je spektar?
Općenito, u ovom obliku ovo pitanje potiče čitatelja da se prisjeti lekcija iz fizike i beskrajnih formula. Međutim, ovaj koncept pokriva puno više raznolikosti i nadilazi školski kurikulum. Dakle, spektar je distribucija vrijednosti određene veličine (ponekad koncept). Pod veličinom, naravno, često podrazumijevaju specifičnu masu, energiju, valnu duljinu. Ali postoje i druge distribucije. Na primjer, žena zna skuhati dva jela - to je njezin kulinarski spektar. Ili čovjek može piti kavu, kompot, čaj, ali ne prihvaća alkohol, što znači da mu je izbor pića ograničen. Odnosno, postoje vrste spektara koji su potpuno nepovezani sa znanošću. Fizika u gornjim primjerima ne igra nikakvu ulogu.
Elektromagnetska vaga

Međutim, najčešće ljudi čuju ovaj koncept kada govore o znanosti (osobito o elektromagnetskoj ljestvici). Odakle dolaze elektromagnetski valovi? Sam mehanizam njihovog nastanka još uvijek je misterij. Općenito, područje ne čestica, već polja vrlo je tajanstveno. Međutim, poznato je da elektromagnetska polja (a time i valovi) nastaju u prisutnosti naboja koji se kreće u prostoru. I ovisno o tome što je i kako se kreće, na elektromagnetskoj ljestvici pojavljuju se različite vrste zračenja. Spektar se u ovom slučaju razmatra ovisno o valnoj duljini. Podsjetimo se da se ovaj izraz odnosi na minimalnu udaljenost između identičnih faza susjednih poremećaja (jednostavnije rečeno, između uzastopnih maksimuma ili minimuma). Najduže valne duljine imaju radio valovi, a najkraće gama zrake. Ono što ljudsko oko vidi samo je mali dio cijelog raspona i nalazi se bliže vrhu ljestvice. Stoga se vrste spektara prvenstveno razlikuju po valnoj duljini ili frekvenciji.
Spektroskopija
U kognitivnom dijelu ovog članka opisani su neki osnovni pojmovi. Ipak, najvažnija stvar u svakom istraživanju je njegova relevantnost.

Drugim riječima, opseg. U ovom dijelu prednjače sve vrste spektra. Koriste se posvuda: od forenzike do stvaranja novih tvari, od biologije do međuzvjezdanog prostora. Znanost koja se usredotočuje na ovaj fizički koncept, kao što je čitatelj sigurno već shvatio, zove se spektroskopija. U ovom trenutku, vrste spektra (spektralna analiza - odnosno) razlikuju se prema nekoliko kriterija.
Vrste spektra
Kao što je spomenuto, prvi kriterij je valna duljina. Podsjetimo se da je frekvencija vala obrnuto proporcionalna duljini - ovi pojmovi su neprekidno povezani. Prema područjima na elektromagnetskoj ljestvici razlikuju se radijski, ultraljubičasti, vidljivi, infracrveni, rendgenski tipovi spektra. Drugi kriterij je geometrija eksperimenta. Snimanje za refleksiju i prijenos spektra može se bitno razlikovati.

Analiza razlike može puno reći o tvari koja se proučava. Na primjer, na taj su način doneseni zaključci o sastavu i gustoći Saturnovih prstenova.
Linije i pruge
Šala o kuglastom konju u vakuumu samo je pola šale. Pedeset posto, ako ne i većina fizičkih pojmova u prirodi ne postoji u svom čistom obliku. Stoga je sljedeći kriterij, koji razdvaja vrste spektara, uvjetan. Jedan idealni atom (ili molekula) materije u apsolutnom vakuumu dat će distribuciju elektromagnetskih signala, koja se sastoji od tankih linija. Ovi uvjeti nisu izvedivi, ali unatoč tome vrlo uske trake s pojedinačnim komponentama unutar kojih se ne može razlikovati smatraju se linijskim spektrom. U pravilu je to skup stupaca različitih visina (označava intenzitet) na odgovarajućim valnim duljinama. Međutim, postoje i druge vrste spektara, koji se nazivaju trakasti spektri: svaka linija ima široke, mutne rubove.
Plavo nebo
Pitanje zašto je nebo plavo postavlja svaki četverogodišnji vrpoljac. Odgovor je istovremeno jednostavan i složen: ima takvu boju jer mikrooscilacije (koje se nazivaju fluktuacije) zemljine atmosfere iz čitavog Sunčevog spektra raspršuju samo odgovarajuće područje valne duljine. Sve ostalo se apsorbira (u većoj mjeri) ili reflektira.

Ovo je još jedan kriterij. Odnosno, postoje apsorpcijski, emisijski i spektri raspršenja. Svako istraživanje daje svoje rezultate. Ali glavne informacije o tvari nose različite vrste emisijskih spektara. Oni daju nedvosmislen odgovor na to što iu kojoj količini je prisutno u tvari koja se proučava. Druga dva prikaza će pokazati složenost strukture i načine na koje njezini pojedinačni dijelovi međusobno djeluju.
Mjesečev kamen
Za što je i koji spektar odgovoran, pokazat ćemo na primjeru kaldrme dopremljene s Mjeseca. Natjerate li kamen da svijetli raznim manipulacijama, dobiveni spektar će nedvosmisleno pokazati koje kemijske elemente Mendelejevljevog sustava sadrži. Drugi postupci mogu izdvojiti koncentracije detektiranih elemenata iz istih spektara. Međutim, čvrsto tijelo i njegova svojstva određuju se ne samo onim od čega se sastoji, već i o tome kako su ti odvojeni elementarni dijelovi smješteni jedan u odnosu na drugi. Klasičan primjer su grafit i dijamant. U oba slučaja radi se o prirodnom ugljiku. Ali atomi su povezani na različite načine - i dobivamo vrlo mekane i najtvrđe prirodne materijale. Zašto domaći? Jer i to je osnova života. Inače, osim spomenutih oblika, tu su i fulereni, te nanocijevi, te nedavno otkriveni grafen za koji su znanstvenici dobili Nobelovu nagradu. Istina, u potonjem slučaju vrijedi spomenuti da je tvar dvodimenzionalna, što značajno mijenja cijelu ideju tankih slojeva tvari. Dakle, spektroskopija raspršenja će reći o strukturi čvrste tvari, o mineralima koji su uključeni u njen sastav. Na primjer, Ramanove linije (ako se ispravno protumače) do nekoliko jediničnih ćelija određuju strukturu kristala. Ali analiza apsorpcijskog ruba, odnosno njegovih detalja: kut nagiba, prisutnost anomalija u obliku odstupanja od linearnog oblika, pomaže pronaći stupanj harmonije ove strukture, odnosno pokazati koji su kristali u kamenu s Mjeseca bistri ili je tvar gotovo amorfna?

Prema tim podacima stručnjaci izračunavaju porijeklo supstance kamena, kao i metamorfozu stijena koje čine njegov sastav.
digitalni svijet
Modernost je nezamisliva bez digitalnih tehnologija. I što je najvažnije, ne brzina procesora ili broj gigabajta RAM-a, već enkripcija signala. Naravno, to je važno prvenstveno za ona područja gdje je potrebna povjerljivost - u bankarstvu, osobnoj komunikaciji putem interneta. Ali čak i jednostavno snimanje filma na disk je šifriranje. Uostalom, laser ne spaljuje slike, već nule i jedinice. Ljudi koji se bave kreiranjem i obradom fotografija znaju koliko "teži" slika u originalnom Raw formatu. Za neupućene, otkrijmo jednu tajnu: puno. Jer svaki piksel ima vlastitu nijansu i osvjetljenje. No nama poznati jpeg, tiff ili čak bmp zauzimaju puno manje prostora na mediju za pohranu, dok vidljiva kvaliteta nije ništa lošija.
Pa u čemu je tajna? Odgovor su vrste spektra signala i opcije za njegovu kompresiju. Fourier je dokazao da se svaki signal može rastaviti na više funkcija s dovoljno visokom točnošću. Dakle, svaki piksel uobičajenih fotografskih formata ne prikazuje izravno fiksiranu boju, već spektar signala. Neki video formati ne koriste Fourierovu transformaciju, već valićnu transformaciju za dekodiranje malih dijelova jedinica i nula u određenu sliku. Dakle, izgubivši vrlo mali (manje od jedan posto) dio slike, možete značajno, ponekad sto puta, smanjiti količinu prostora zauzetog na disku ili flash kartici.
Formula tanke leće
Formula tanke leće povezuje d (udaljenost od predmeta do optičkog središta leće), f (udaljenost od optičkog središta do slike) sa žarišnom duljinom F (sl. 101).
Trokut ABO sličan je trokutu OB 1 A 1 . Iz sličnosti proizlazi da

Trokut OCF sličan je trokutu FB 1 A 1 . Iz sličnosti proizlazi da

Ovo je formula tankih leća.
Udaljenosti F, d i f od leće do stvarnih točaka uzete su s predznakom plus, udaljenosti od leće do zamišljenih točaka uzete su s predznakom minus.
Omjer veličine slike H i linearne veličine predmeta h naziva se linearno povećanje leće G.

Spektralni sastav zračenja tvari vrlo je raznolik. Ali, unatoč tome, svi spektri, kako pokazuje iskustvo, mogu se podijeliti u tri vrste.
Kontinuirani spektri. Sunčev spektar ili spektar svjetla luka je kontinuiran. To znači da u spektru postoje valovi svih valnih duljina. U spektru nema diskontinuiteta, a na ekranu spektrografa se može vidjeti kontinuirana raznobojna traka (vidi sliku V, 1 na umetku u boji).
Frekvencijska raspodjela energije, odnosno spektralna gustoća intenziteta zračenja, različita je za različita tijela. Na primjer, tijelo s vrlo crnom površinom emitira elektromagnetske valove svih frekvencija, ali ovisnost spektralne gustoće intenziteta zračenja o frekvenciji ima maksimum na određenoj frekvenciji Vmax (sl. 10.3). Energija zračenja koja se može pripisati vrlo malim (V -> 0) i vrlo visokim (v -> v ) frekvencijama je zanemariva. S porastom tjelesne temperature maksimalna spektralna gustoća zračenja pomiče se prema kratkim valovima.
Kontinuirani (ili kontinuirani) spektri, kako pokazuje iskustvo, daju tijela koja su u krutom ili tekućem stanju, kao i visoko komprimirane plinove. Za dobivanje kontinuiranog spektra potrebno je tijelo zagrijati na visoku temperaturu.
Priroda kontinuiranog spektra i sama činjenica njegovog postojanja nisu određeni samo svojstvima pojedinačnih atoma koji zrače, već također u velikoj mjeri ovise o međudjelovanju atoma s drugima.
Kontinuirani spektar također proizvodi visokotemperaturna plazma. Elektromagnetske valove emitira plazma uglavnom u sudarima elektrona s ionima.
Linijski spektri. U blijedi plamen plinskog plamenika ubacimo komadić azbesta navlažen otopinom kuhinjske soli. Promatrajući plamen kroz spektroskop, vidjet ćemo kako svijetlo žuta linija bljeska na pozadini jedva vidljivog kontinuiranog spektra plamena (vidi sl. V, 2 na umetku u boji).

Ovu žutu liniju daju pare natrija, koje nastaju tijekom cijepanja molekula natrijevog klorida u plamenu. Umetak u boji također prikazuje spektre vodika i helija. Svaki od spektara je palisada obojenih linija različite svjetline, odvojenih širokim tamnim trakama. Takvi se spektri nazivaju linijski spektri. Prisutnost linijskog spektra znači da tvar emitira svjetlost samo sasvim određenih valnih duljina (točnije, u određenim vrlo uskim spektralnim intervalima). Na slici 10.4 prikazana je približna raspodjela spektralne gustoće intenziteta zračenja u linijskom spektru. Svaka linija ima konačnu širinu.

Linijski spektri daju sve tvari u plinovitom atomskom (ali ne i molekularnom) stanju. U ovom slučaju svjetlost emitiraju atomi koji praktički ne djeluju jedni na druge. Ovo je najtemeljniji, osnovni tip spektra.
Izolirani atomi emitiraju svjetlost strogo definiranih valnih duljina.
Obično se linijski spektri promatraju pomoću sjaja para tvari u plamenu ili sjaja plinskog pražnjenja u cijevi ispunjenoj plinom koji se proučava.
Kako se gustoća atomskog plina povećava, pojedine spektralne linije se šire i, konačno, pri vrlo visokoj kompresiji plina, kada interakcija atoma postane značajna, te se linije međusobno preklapaju, tvoreći kontinuirani spektar.
Prugasti spektri. Prugasti spektar sastoji se od pojedinačnih traka odvojenih tamnim prazninama. Uz pomoć vrlo dobrog spektralnog aparata, može se ustanoviti da je svaki pojas skup velikog broja vrlo blisko razmaknutih linija. Za razliku od linijskih spektara, prugasti spektri nisu formirani od atoma, već od molekula koje nisu međusobno povezane ili su slabo povezane.
Za promatranje molekulskih spektara, kao i za promatranje linijskih spektara, koristi se sjaj para tvari u plamenu ili sjaj plinskog izboja.
Apsorpcijski spektri. Sve tvari čiji su atomi u pobuđenom stanju emitiraju svjetlosne valove. Energija ovih valova raspoređena je na određeni način po valnim duljinama. Apsorpcija svjetlosti od tvari također ovisi o valnoj duljini. Dakle, crveno staklo propušta valove koji odgovaraju crvenoj svjetlosti (8 10 -5 cm), a sve ostalo apsorbira.
Ako bijelo svjetlo prolazi kroz hladan plin koji ne zrači, tada se tamne linije pojavljuju na pozadini kontinuiranog spektra izvora (vidi sliku V, 5-8 na umetku u boji). Plin najintenzivnije apsorbira svjetlost upravo onih valnih duljina koju sam emitira u jako zagrijanom stanju. Tamne linije na pozadini kontinuiranog spektra su apsorpcijske linije, koje zajedno tvore apsorpcijski spektar.
Postoje kontinuirani, linijski i prugasti emisijski spektri te isti broj apsorpcijskih spektara.
Spektralna analiza- skup metoda za kvalitativno i kvantitativno određivanje sastava objekta, koji se temelji na proučavanju spektara interakcije tvari sa zračenjem, uključujući spektre elektromagnetskog zračenja, akustičnih valova, raspodjele mase i energije elementarnih čestica, itd.
Ovisno o namjeni analize i vrstama spektra, postoji nekoliko metoda spektralne analize. Atomski i molekularni spektralne analize omogućuju određivanje elementarnog, odnosno molekularnog sastava tvari. U emisijskim i apsorpcijskim metodama sastav se određuje iz emisijskih i apsorpcijskih spektara.
Masena spektrometrijska analiza provodi se pomoću spektra mase atomskih ili molekularnih iona i omogućuje određivanje izotopskog sastava objekta.
Ministarstvo obrazovanja i znanosti
Republika Kazahstan
Državno sveučilište u Karagandi
nazvan po E.A. Buketova
Fizički fakultet
Zavod za optiku i spektroskopiju
Tečajni rad
na temu:
Spektri. IZ spektralna analiza i njena primjena.
Pripremio:
student grupe FTRF-22
Akhtariev Dmitry.
Provjereno:
učitelj, nastavnik, profesor
Kusenova Asiya Sabirgalievna
Karaganda - 2003
Plan
Uvod
1. Energija u spektru
2. Vrste spektara
3. Spektralna analiza i njezina primjena
4. Spektralni uređaji
5. Spektar elektromagnetskog zračenja
Zaključak
Popis korištene literature
Uvod
Proučavanje linijskog spektra tvari omogućuje vam da odredite od kojih se kemijskih elemenata sastoji i koliko je svaki element sadržan u određenoj tvari.
Kvantitativni sadržaj elementa u ispitivanom uzorku određuje se usporedbom intenziteta pojedinih linija spektra tog elementa s intenzitetom linija drugog kemijskog elementa, čiji je kvantitativni sadržaj u uzorku poznat.
Metoda određivanja kvalitativnog i kvantitativnog sastava tvari pomoću spektra naziva se spektralna analiza. Spektralna analiza naširoko se koristi u istraživanju minerala za određivanje kemijskog sastava uzoraka rude. U industriji, spektralna analiza omogućuje kontrolu sastava legura i nečistoća uvedenih u metale kako bi se dobili materijali sa željenim svojstvima.
Prednosti spektralne analize su visoka osjetljivost i brzi rezultati. Spektralnom analizom moguće je otkriti prisutnost zlata u uzorku težine 6 * 10 -7 g, dok je njegova masa samo 10 -8 g. Određivanje kvalitete čelika spektralnom analizom može se izvršiti za nekoliko desetaka sekundi. .
Spektralna analiza omogućuje određivanje kemijskog sastava nebeskih tijela koja su milijardama svjetlosnih godina udaljena od Zemlje. Kemijski sastav atmosfere planeta i zvijezda, hladnog plina u međuzvjezdanom prostoru određen je apsorpcijskim spektrima.
Proučavajući spektre, znanstvenici su mogli odrediti ne samo kemijski sastav nebeskih tijela, već i njihovu temperaturu. Po pomaku spektralnih linija može se odrediti brzina nebeskog tijela.
Energija u spektru.
Izvor svjetlosti mora trošiti energiju. Svjetlost su elektromagnetski valovi valne duljine 4 * 10 -7 - 8 * 10 -7 m. Elektromagnetski valovi emitiraju se tijekom ubrzanog kretanja nabijenih čestica. Ove nabijene čestice dio su atoma. Ali, ne znajući kako je atom raspoređen, ne može se reći ništa pouzdano o mehanizmu zračenja. Jasno je samo da unutar atoma nema svjetla, kao što nema zvuka u žici klavira. Poput žice koja počinje zvučati tek nakon udarca čekića, atomi rađaju svjetlost tek nakon što su pobuđeni.
Da bi atom mogao zračiti, mora prenijeti energiju. Atom zračenjem gubi primljenu energiju, a za kontinuirani sjaj tvari neophodan je dotok energije njezinim atomima izvana.
Toplinsko zračenje. Najjednostavnija i najčešća vrsta zračenja je toplinsko zračenje, kod kojeg se gubitak energije atoma za emisiju svjetlosti nadoknađuje energijom toplinskog gibanja atoma ili (molekula) tijela koje zrači. Što je viša temperatura tijela, atomi se brže kreću. Kada se brzi atomi (molekule) sudaraju jedan s drugim, dio njihove kinetičke energije pretvara se u energiju pobude atoma, koji tada emitiraju svjetlost.
Izvor topline zračenja je Sunce, kao i obična žarulja sa žarnom niti. Svjetiljka je vrlo prikladan, ali neekonomičan izvor. Samo oko 12% sve energije koju u svjetiljci oslobodi električna struja pretvara se u svjetlosnu energiju. Izvor topline svjetlosti je plamen. Zrnca čađe zagrijavaju se energijom koja se oslobađa pri izgaranju goriva i emitiraju svjetlost.
Elektroluminiscencija. Energija potrebna atomima za emitiranje svjetlosti također se može posuditi iz izvora koji nisu toplinski. Pri pražnjenju u plinovima električno polje prenosi veliku kinetičku energiju elektronima. Brzi elektroni doživljavaju sudare s atomima. Dio kinetičke energije elektrona odlazi na pobuđivanje atoma. Pobuđeni atomi odaju energiju u obliku svjetlosnih valova. Zbog toga je pražnjenje u plinu popraćeno sjajem. Ovo je elektroluminiscencija.
katodoluminiscencija. Sjaj čvrstih tijela uzrokovan njihovim bombardiranjem elektronima naziva se katodoluminiscencija. Katodoluminiscencija čini da ekrani katodnih cijevi na televizorima svijetle.
Kemiluminiscencija. U nekim kemijskim reakcijama koje oslobađaju energiju, dio te energije se izravno troši na emisiju svjetlosti. Izvor svjetla ostaje hladan (ima temperaturu okoline). Ova pojava se naziva kemioluminiscencija.
Fotoluminiscencija. Svjetlost koja pada na tvar se dijelom reflektira, a dijelom apsorbira. Energija apsorbirane svjetlosti u većini slučajeva uzrokuje samo zagrijavanje tijela. Međutim, neka tijela sama počinju svijetliti izravno pod djelovanjem zračenja koje pada na njih. Ovo je fotoluminiscencija. Svjetlost pobuđuje atome materije (povećava njihovu unutarnju energiju), nakon čega se oni sami osvjetljavaju. Na primjer, svjetleće boje, kojima su prekriveni mnogi božićni ukrasi, emitiraju svjetlost nakon što su ozračene.
Svjetlost emitirana tijekom fotoluminiscencije ima u pravilu veću valnu duljinu od svjetlosti koja pobuđuje sjaj. To se može promatrati eksperimentalno. Ako se svjetlosni snop koji prođe kroz ljubičasti svjetlosni filtar usmjeri na posudu s fluoresceitom (organska boja), tada ova tekućina počinje svijetliti zeleno-žutom svjetlošću, tj. svjetlošću veće valne duljine od one ljubičaste svjetlosti.
Fenomen fotoluminiscencije naširoko se koristi u fluorescentnim svjetiljkama. Sovjetski fizičar S. I. Vavilov predložio je prekrivanje unutarnje površine cijevi za pražnjenje tvarima koje mogu jarko svijetliti pod djelovanjem kratkovalnog zračenja iz plinskog pražnjenja. Fluorescentne svjetiljke su oko tri do četiri puta ekonomičnije od konvencionalnih žarulja sa žarnom niti.
Navedene su glavne vrste zračenja i izvori koji ih stvaraju. Najčešći izvori zračenja su toplinski.
Raspodjela energije u spektru. Nijedan od izvora ne daje monokromatsku svjetlost, odnosno svjetlost strogo određene valne duljine. U to nas uvjeravaju pokusi rastavljanja svjetlosti na spektar uz pomoć prizme, kao i pokusi interferencije i difrakcije.
Energija koju svjetlost iz izvora nosi sa sobom raspoređuje se na određeni način po valovima svih valnih duljina koji čine svjetlosni snop. Također možemo reći da je energija raspoređena po frekvencijama, jer postoji jednostavan odnos između valne duljine i frekvencije: ђv = c.
Gustoća toka elektromagnetskog zračenja, ili intenzitet /, određena je energijom &W koja se može pripisati svim frekvencijama. Za karakterizaciju raspodjele zračenja po frekvencijama potrebno je uvesti novu vrijednost: intenzitet po jedinici frekvencijskog intervala. Ta se vrijednost naziva spektralna gustoća intenziteta zračenja.
Spektralna gustoća toka zračenja može se odrediti eksperimentalno. Za to je potrebno pomoću prizme dobiti spektar zračenja, na primjer, električnog luka, te izmjeriti gustoću toka zračenja koja pada na male spektralne intervale širine Av.
Ne možete se osloniti na oko kada procjenjujete distribuciju energije. Oko ima selektivnu osjetljivost na svjetlost: maksimum njegove osjetljivosti nalazi se u žuto-zelenom području spektra. Najbolje je iskoristiti svojstvo crnog tijela da gotovo potpuno apsorbira svjetlost svih valnih duljina. U ovom slučaju energija zračenja (tj. svjetlost) uzrokuje zagrijavanje tijela. Stoga je dovoljno izmjeriti tjelesnu temperaturu i na temelju nje procijeniti količinu apsorbirane energije u jedinici vremena.
Obični termometar je previše osjetljiv da bi se mogao uspješno koristiti u takvim pokusima. Potrebni su osjetljiviji instrumenti za mjerenje temperature. Možete uzeti električni termometar, u kojem je osjetljivi element izrađen u obliku tanke metalne ploče. Ova ploča mora biti prekrivena tankim slojem čađe, koji gotovo potpuno apsorbira svjetlost bilo koje valne duljine.
Toplinski osjetljivu ploču instrumenta treba postaviti na jedno ili drugo mjesto u spektru. Cijeli vidljivi spektar duljine l od crvenih zraka do ljubičastih odgovara frekvencijskom intervalu od v kr do y f. Širina odgovara malom intervalu Av. Zagrijavanjem crne ploče uređaja može se prosuditi gustoća toka zračenja po frekvencijskom intervalu Av. Pomičući ploču duž spektra, nalazimo da je većina energije u crvenom dijelu spektra, a ne u žuto-zelenom, kako se oku čini.
Na temelju rezultata ovih pokusa moguće je nacrtati ovisnost spektralne gustoće intenziteta zračenja o frekvenciji. Spektralna gustoća intenziteta zračenja određena je temperaturom ploče, a frekvenciju nije teško pronaći ako je uređaj za razlaganje svjetlosti kalibriran, odnosno ako se zna kojoj frekvenciji odgovara zadani dio spektra. do.
Iscrtavajući duž osi apscise vrijednosti frekvencija koje odgovaraju srednjim točkama Av intervala, a duž osi ordinata spektralnu gustoću intenziteta zračenja, dobivamo niz točaka kroz koje se može povući glatka krivulja. Ova krivulja daje vizualni prikaz distribucije energije i vidljivog dijela spektra električnog luka.
Vrste spektara.
Spektralni sastav zračenja raznih tvari vrlo je raznolik. Ali, unatoč tome, svi spektri, kao što iskustvo pokazuje, mogu se podijeliti u tri vrste koje se međusobno vrlo razlikuju.
Kontinuirani spektri.
Sunčev spektar ili spektar svjetla luka je kontinuiran. To znači da su u spektru zastupljene sve valne duljine. U spektru nema diskontinuiteta, a na ekranu spektrografa se vidi kontinuirana raznobojna traka.
Frekvencijska raspodjela energije, odnosno spektralna gustoća intenziteta zračenja, različita je za različita tijela. Na primjer, tijelo s vrlo crnom površinom zrači elektromagnetske valove svih frekvencija, ali krivulja ovisnosti spektralne gustoće intenziteta zračenja o frekvenciji ima maksimum na određenoj frekvenciji. Energija zračenja koja se može pripisati vrlo malim i vrlo visokim frekvencijama zanemariva je. Kako temperatura raste, maksimalna spektralna gustoća zračenja pomiče se prema kratkim valovima.
Kontinuirani (ili kontinuirani) spektri, kako iskustvo pokazuje, daju tijela koja su u krutom ili tekućem stanju, kao i visoko komprimirane plinove. Da biste dobili kontinuirani spektar, morate zagrijati tijelo na visoku temperaturu.
Priroda kontinuiranog spektra i sama činjenica njegovog postojanja određuju se ne samo svojstvima pojedinačnih atoma koji zrače, već također u velikoj mjeri ovise o međudjelovanju atoma s drugima.
Linijski spektri.
U blijedi plamen plinskog plamenika stavimo komadić azbesta namočen u otopinu kuhinjske soli. Pri promatranju plamena kroz spektroskop, svijetložuta linija bljeska na pozadini jedva vidljivog kontinuiranog spektra plamena. Ovu žutu liniju daju pare natrija, koje nastaju tijekom cijepanja molekula natrijevog klorida u plamenu. Na spektroskopu se također može vidjeti palisada obojenih linija različite svjetline, odvojenih širokim tamnim trakama. Takvi se spektri nazivaju vladao. Prisutnost linijskog spektra znači da tvar emitira svjetlost samo sasvim određenih valnih duljina (točnije, u određenim vrlo uskim spektralnim intervalima). Svaka od linija ima konačnu širinu.
Linijski spektri daju sve tvari u plinovitom atomskom ( ali ne molekularni stanje. U ovom slučaju svjetlost emitiraju atomi koji praktički ne djeluju jedni na druge. Ovo je najtemeljniji, osnovni tip spektra.
Izolirani atomi određenog kemijskog elementa emitiraju strogo određene valne duljine.
Obično se linijski spektri promatraju pomoću sjaja para tvari u plamenu ili sjaja plinskog pražnjenja u cijevi ispunjenoj plinom koji se proučava.
S povećanjem gustoće atomskog plina, pojedine spektralne linije se šire i, konačno, pri vrlo visokoj gustoći plina, kada interakcija atoma postane značajna, te se linije međusobno preklapaju, tvoreći kontinuirani spektar.
Prugasti spektri.
Prugasti spektar sastoji se od pojedinačnih traka odvojenih tamnim prazninama. Uz pomoć vrlo dobrog spektralnog aparata, može se ustanoviti da je svaki pojas skup velikog broja vrlo blisko razmaknutih linija. Za razliku od linijskih spektara, prugaste spektre ne proizvode atomi, već molekule koje nisu međusobno povezane ili su slabo povezane.
Za promatranje molekularnih spektara, kao i za promatranje linijskih spektara, obično se koristi sjaj para u plamenu ili sjaj plinskog izboja.
Apsorpcijski spektri.
Sve tvari čiji su atomi u pobuđenom stanju emitiraju svjetlosne valove čija je energija na određeni način raspoređena po valnim duljinama. Apsorpcija svjetlosti od tvari također ovisi o valnoj duljini. Dakle, crveno staklo propušta valove koji odgovaraju crvenoj svjetlosti (l»8 10 -5 cm), a sve ostalo apsorbira.
Ako se bijela svjetlost propusti kroz hladan plin koji ne zrači, tada se pojavljuju tamne linije na pozadini kontinuiranog spektra izvora. Plin najintenzivnije upija svjetlost upravo onih valnih duljina koje emitira kada je jako vruće. Tamne linije na pozadini kontinuiranog spektra su apsorpcijske linije, koje zajedno tvore apsorpcijski spektar.
Postoje kontinuirani, linijski i prugasti emisijski spektri te isti broj apsorpcijskih spektara.
Važno je znati od čega su građena tijela oko nas. Za određivanje njihovog sastava osmišljene su mnoge metode. Ali sastav zvijezda i galaksija može se znati samo uz pomoć spektralne analize.
Spektralna analiza i njezina primjena
Linijski spektri imaju posebno važnu ulogu jer je njihova struktura izravno povezana sa strukturom atoma. Uostalom, te spektre stvaraju atomi koji ne doživljavaju vanjske utjecaje. Stoga, upoznavanjem s linijskim spektrom, činimo prvi korak prema proučavanju strukture atoma. Promatrajući te spektre, znanstvenici su mogli "pogledati" u unutrašnjost atoma. Ovdje optika dolazi u bliski dodir s atomskom fizikom.
Glavno svojstvo linijskih spektara je da valne duljine (ili frekvencije) linijskog spektra tvari ovise samo o svojstvima atoma te tvari, ali su potpuno neovisne o načinu pobuđivanja luminiscencije atoma. Atomi bilo kojeg kemijskog elementa odaju spektar koji se razlikuje od spektra svih drugih elemenata: oni su sposobni emitirati strogo definiran skup valnih duljina.
Na temelju ovoga spektralnianaliza- metoda za određivanje kemijskog sastava tvari po spektru. Poput ljudskih otisaka prstiju, linijski spektri imaju jedinstvenu osobnost. Jedinstvenost uzoraka na koži prsta često pomaže pronaći kriminalca. Na isti način, zbog individualnosti spektra, moguće je odrediti kemijski sastav tijela. Uz pomoć spektralne analize moguće je otkriti ovaj element u sastavu složene tvari, čak i ako njegova masa ne prelazi 10 -10. Ovo je vrlo osjetljiva metoda.
Kvantitativna analiza sastava tvari po spektru je teška, budući da svjetlina spektralnih linija ne ovisi samo o masi tvari, već io načinu pobuđivanja sjaja. Stoga se pri niskim temperaturama mnoge spektralne linije uopće ne pojavljuju. Međutim, pod standardnim uvjetima za pobuđivanje luminiscencije, može se provesti i kvantitativna spektralna analiza.
Trenutno su određeni spektri svih atoma i sastavljene su tablice spektara. Uz pomoć spektralne analize otkriveni su mnogi novi elementi: rubidij, cezij i dr. Elementi su se često nazivali prema boji najintenzivnijih linija spektra. Rubidij daje tamnocrvene, rubin linije. Riječ cezij znači "nebesko plavo". Ovo je boja glavnih linija spektra cezija.
Upravo su uz pomoć spektralne analize saznali kemijski sastav Sunca i zvijezda. Druge metode analize ovdje su općenito nemoguće. Ispostavilo se da su zvijezde sastavljene od istih kemijskih elemenata koji se nalaze na Zemlji. Zanimljivo je da je helij prvotno otkriven na Suncu, a tek potom pronađen u Zemljinoj atmosferi. Naziv ovog elementa podsjeća na povijest njegovog otkrića: riječ helij znači "sunčan".
Zbog svoje komparativne jednostavnosti i svestranosti, spektralna analiza je glavna metoda za praćenje sastava tvari u metalurgiji, strojarstvu i nuklearnoj industriji. Uz pomoć spektralne analize utvrđuje se kemijski sastav ruda i minerala.
Sastav složenih, uglavnom organskih, smjesa analizira se njihovim molekulskim spektrima.
Spektralna analiza može se provesti ne samo iz emisijskih, već i iz apsorpcijskih spektara. Upravo apsorpcijske linije u spektru Sunca i zvijezda omogućuju proučavanje kemijskog sastava ovih nebeskih tijela. Jarko blistava površina Sunca - fotosfera - daje kontinuirani spektar. Sunčeva atmosfera selektivno apsorbira svjetlost iz fotosfere, što dovodi do pojave apsorpcijskih linija na pozadini kontinuiranog spektra fotosfere.
Ali sama atmosfera Sunca emitira svjetlost. Tijekom pomrčine Sunca, kada je Sunčev disk prekriven Mjesecom, linije spektra su obrnute. Umjesto apsorpcijskih linija u Sunčevom spektru bljeskaju emisijske linije.
U astrofizici se pod spektralnom analizom podrazumijeva ne samo određivanje kemijskog sastava zvijezda, oblaka plina itd., već i pronalaženje mnogih drugih fizičkih karakteristika tih objekata iz spektra: temperature, tlaka, brzine, magnetske indukcije.
Osim u astrofizici, spektralna analiza naširoko se koristi u forenzici, za istraživanje dokaza pronađenih na mjestu zločina. Također, spektralna analiza u forenzici pomaže odrediti oružje ubojstva i, općenito, otkriti neke pojedinosti zločina.
Spektralna analiza se još više koristi u medicini. Ovdje je njegova primjena vrlo široka. Može se koristiti za dijagnosticiranje, kao i za određivanje stranih tvari u ljudskom tijelu.
Spektralna analiza ne unapređuje samo znanost, već i društvenu sferu ljudskog djelovanja.
Spektralna analiza zahtijeva posebne spektralne instrumente, koje ćemo dalje razmotriti.
Spektralni aparat
Za točnu studiju spektra više nisu dovoljni tako jednostavni uređaji kao što su uski prorez koji ograničava svjetlosni snop i prizma. Potrebni su instrumenti koji daju jasan spektar, odnosno instrumenti koji dobro odvajaju valove različitih valnih duljina i ne dopuštaju preklapanje pojedinih dijelova spektra. Takvi uređaji nazivaju se spektralni uređaji. Najčešće je glavni dio spektralnog aparata prizma ili difrakcijska rešetka.
Razmotrite shemu uređaja spektralnog aparata prizme. Proučavano zračenje prvo ulazi u dio uređaja koji se naziva kolimator. Kolimator je cijev na čijem se jednom kraju nalazi zaslon s uskim prorezom, a na drugom - konvergentna leća. Prorez je na žarišnoj udaljenosti od leće. Stoga divergentni snop svjetlosti koji ulazi u leću iz proreza izlazi iz nje u paralelnom snopu i pada na prizmu.
Budući da različite frekvencije odgovaraju različitim indeksima loma, iz prizme izlaze paralelne zrake koje se ne podudaraju u smjeru. Padaju na objektiv. Na žarišnoj duljini ovog objektiva nalazi se ekran - matirano staklo ili fotografska ploča. Leća fokusira paralelne snopove zraka na ekranu i umjesto jedne slike proreza dobiva se cijeli niz slika. Svaka frekvencija (uski spektralni interval) ima svoju sliku. Sve te slike zajedno čine spektar.
Opisani instrument naziva se spektrograf. Ako se umjesto druge leće i ekrana koristi teleskop za vizualno promatranje spektra, tada se uređaj naziva spektroskop. Prizme i drugi detalji spektralnih uređaja nisu nužno izrađeni od stakla. Umjesto stakla koriste se i prozirni materijali poput kvarca, kamene soli i sl.
Upoznali ste se s novom veličinom - spektralnom gustoćom intenziteta zračenja. Saznali smo što se nalazi u kućištu spektralnog aparata.
Spektralni sastav zračenja tvari vrlo je raznolik. Ali, unatoč tome, svi spektri, kako pokazuje iskustvo, mogu se podijeliti u tri vrste.
Spektar elektromagnetskog zračenja
Svojstva elektromagnetskog zračenja. Elektromagnetska zračenja različitih valnih duljina imaju dosta razlika, ali sva su, od radio valova do gama zračenja, iste fizičke prirode. Sve vrste elektromagnetskog zračenja, u većoj ili manjoj mjeri, pokazuju svojstva interferencije, difrakcije i polarizacije svojstvena valovima. Istovremeno, sve vrste elektromagnetskog zračenja u većoj ili manjoj mjeri pokazuju kvantna svojstva.
Svim elektromagnetskim zračenjima zajednički su mehanizmi njihova nastanka: elektromagnetski valovi bilo koje valne duljine mogu nastati tijekom ubrzanog kretanja električnih naboja ili tijekom prijelaza molekula, atoma ili atomskih jezgri iz jednog kvantnog stanja u drugo. Harmonijske oscilacije električnih naboja praćene su elektromagnetskim zračenjem čija je frekvencija jednaka frekvenciji oscilacija naboja.
Radio valovi. Oscilacijama koje se javljaju na frekvencijama od 10 5 do 10 12 Hz dolazi do elektromagnetskog zračenja čije su valne duljine u rasponu od nekoliko kilometara do nekoliko milimetara. Ovaj dio ljestvice elektromagnetskog zračenja odnosi se na područje radio valova. Radio valovi se koriste za radio komunikacije, televiziju i radar.
Infracrveno zračenje. Elektromagnetsko zračenje valne duljine manje od 1-2 mm, ali veće od 8 * 10 -7 m, tj. koji leže između raspona radio valova i raspona vidljive svjetlosti nazivaju se infracrveno zračenje.
Područje spektra iza njegovog crvenog ruba prvi je put eksperimentalno istraženo 1800. godine. Engleski astronom William Herschel (1738-1822). Herschel je postavio crni termometar iza crvenog kraja spektra i otkrio povećanje temperature. Žarulja termometra zagrijavana je oku nevidljivim zračenjem. Ovo zračenje nazivamo infracrvenim zracima.
Infracrveno zračenje emitira svako zagrijano tijelo. Izvori infracrvenog zračenja su peći, bojleri, električne žarulje sa žarnom niti.
Uz pomoć posebnih uređaja infracrveno zračenje može se pretvoriti u vidljivu svjetlost i dobiti slike zagrijanih predmeta u potpunom mraku. Infracrveno zračenje koristi se za sušenje obojenih proizvoda, zidova zgrada, drva.
vidljivo svjetlo. Vidljiva svjetlost (ili jednostavno svjetlost) uključuje zračenje valne duljine od približno 8*10 -7 do 4*10 -7 m, od crvene do ljubičaste svjetlosti.
Značenje ovog dijela spektra elektromagnetskog zračenja u ljudskom životu je izuzetno veliko, budući da čovjek gotovo sve informacije o svijetu oko sebe prima uz pomoć vida.
Svjetlost je preduvjet za razvoj zelenih biljaka, a time i nužan uvjet za postojanje života na Zemlji.
Ultraljubičasto zračenje. Godine 1801. njemački fizičar Johann Ritter (1776. - 1810.), proučavajući spektar, otkrio je da iza njegovog ljubičastog ruba postoji područje koje stvaraju oku nevidljive zrake. Ove zrake utječu na određene kemijske spojeve. Pod utjecajem tih nevidljivih zraka dolazi do razgradnje srebrnog klorida, do sjaja kristala cinkovog sulfida i nekih drugih kristala.
Elektromagnetsko zračenje koje je nevidljivo oku i ima valnu duljinu kraću od ljubičaste svjetlosti naziva se ultraljubičasto zračenje. Ultraljubičasto zračenje uključuje elektromagnetsko zračenje u rasponu valnih duljina od 4 * 10 -7 do 1 * 10 -8 m.
Ultraljubičasto zračenje može ubiti patogene bakterije, pa se naširoko koristi u medicini. Ultraljubičasto zračenje u sastavu sunčeve svjetlosti uzrokuje biološke procese koji dovode do tamnjenja ljudske kože – sunčanice.
Svjetiljke s pražnjenjem koriste se kao izvori ultraljubičastog zračenja u medicini. Cijevi takvih svjetiljki izrađene su od kvarca, prozirne za ultraljubičaste zrake; stoga se ove svjetiljke nazivaju kvarcnim svjetiljkama.
X-zrake. Ako se u vakuumskoj cijevi između zagrijane katode koja emitira elektron i anode dovede konstantan napon od nekoliko desetaka tisuća volti, tada će elektroni prvo biti ubrzani električnim poljem, a zatim naglo usporeni u tvari anode kada u interakciji s njegovim atomima. Tijekom usporavanja brzih elektrona u tvari ili tijekom prijelaza elektrona na unutarnjim ljuskama atoma nastaju elektromagnetski valovi s valnom duljinom kraćom od ultraljubičastog zračenja. Ovo zračenje je 1895. godine otkrio njemački fizičar Wilhelm Roentgen (1845.-1923.). Elektromagnetsko zračenje u području valnih duljina od 10 -14 do 10 -7 m nazivamo x-zrake.
X-zrake su nevidljive oku. Prolaze bez značajne apsorpcije kroz značajne slojeve materijala koji je neproziran za vidljivo svjetlo. X-zrake se detektiraju po njihovoj sposobnosti da izazovu određeni sjaj pojedinih kristala i djeluju na fotografski film.
Sposobnost X-zraka da prodre kroz debele slojeve materije koristi se za dijagnosticiranje bolesti unutarnjih organa čovjeka. U tehnici, X-zrake se koriste za kontrolu unutarnje strukture raznih proizvoda, zavara. X-zračenje ima snažno biološko djelovanje i koristi se u liječenju određenih bolesti.
Gama zračenje. Gama zračenje naziva se elektromagnetsko zračenje koje emitiraju pobuđene atomske jezgre, a nastaje međudjelovanjem elementarnih čestica.
Gama zračenje je elektromagnetsko zračenje najkraće valne duljine (l < 10 -10 m). Njegova značajka su izražena korpuskularna svojstva. Stoga se gama zračenje obično smatra strujom čestica – gama zraka. U području valnih duljina od 10 -10 do 10 -14 i preklapaju se rasponi X-zraka i gama-zračenja, u ovom su području X-zrake i gama-zrake identične prirode, a razlikuju se samo po porijeklu.
Zaključak
Početkom XIX stoljeća. utvrđeno je da je iznad (duž valne duljine) crveni dio spektra vidljive svjetlosti nevidljiv oku infracrveni dio spektra, a ispod ljubičaste dio spektra vidljive svjetlosti je nevidljiv UV dio spektra.
Valne duljine infracrvenog zračenja kreću se od
3·10 -4 do 7,6·10 -7 m. Najkarakterističnije svojstvo ovog zračenja je njegov toplinski učinak. Svako tijelo je izvor infracrvenog zračenja. Intenzitet ovog zračenja je to veći što je viša tjelesna temperatura. Infracrveno zračenje ispituje se pomoću termoparova i bolometara. Princip rada uređaja za noćno gledanje temelji se na korištenju infracrvenog zračenja.
Valne duljine ultraljubičastog zračenja su u rasponu od
4·10 -7 do 6·10 -9 m. Najkarakterističnije svojstvo ovog zračenja je njegovo kemijsko i biološko djelovanje. Ultraljubičasto zračenje uzrokuje pojavu fotoelektričnog efekta, sjaj niza tvari ( fluorescencija i fosforescencija). Ubija mikrobe koji uzrokuju bolesti, uzrokuje opekline od sunca i tako dalje.
U znanosti se infracrveno i ultraljubičasto zračenje koristi za proučavanje molekula i atoma tvari.
Na ekranu iza lomne prizme monokromatske boje u spektru raspoređene su sljedećim redoslijedom: crvena (ima najveću valnu duljinu l k \u003d 7,6 10 -7 m među valovima vidljive svjetlosti i najmanji indeks loma), narančasta, žuta , zelena, plava, plava i ljubičasta (imaju najmanju valnu duljinu u vidljivom spektru l f =4·10 -7 m i najveći indeks loma).
Dakle, spektralna analiza se koristi u gotovo svim najvažnijim područjima ljudske djelatnosti: u medicini, u forenzici, u industriji i drugim industrijama koje postoje za dobrobit čovječanstva. Stoga je spektralna analiza jedan od najvažnijih aspekata razvoja ne samo znanstvenog napretka, već i samog standarda ljudskog života.
Iarajuli Juraj
Emisijski i apsorpcijski spektri.
Preuzimanje datoteka:
Pregled:
Za korištenje pregleda prezentacija kreirajte Google račun (račun) i prijavite se: https://accounts.google.com
Naslovi slajdova:
Spektri. Vrste spektara. Spektralna analiza. Prezentacija o fizici učenika 11. razreda GBOU srednje škole br. 1465 nazvane po admirala N.G. Kuznetsova Iarajuli Georgiy Učiteljica fizike Kruglova Larisa Yurievna
Pojam spektra i osnovne informacije Spektar - distribucija vrijednosti neke fizikalne veličine (obično energije, frekvencije ili mase).Grafički prikaz takve distribucije naziva se spektralni dijagram. Obično se pod spektrom podrazumijeva elektromagnetski spektar - frekvencijski spektar elektromagnetskog zračenja.
Povijest istraživanja U znanstvenoj upotrebi pojam "spektar" uveo je Newton 1671.-1672. kako bi označio traku više boja sličnu dugi, koja se dobiva kada sunčeva zraka prolazi kroz trokutastu staklenu prizmu.
Povijesno gledano, prije svih drugih spektara, počelo je proučavanje optičkih spektara. Prvi je bio Isaac Newton, koji je u znanstvenu upotrebu uveo pojam "spektar" da bi označio vrpcu više boja sličnu dugi koju je dobio u eksperimentima na sunčevoj svjetlosti. U svom djelu "Optika", objavljenom 1704. godine, objavio je rezultate svojih pokusa razlaganja bijele svjetlosti na zasebne komponente različite boje i loma pomoću trokutaste staklene prizme, odnosno dobio je spektre sunčevog zračenja i objasnio njihov prirode, pokazujući da je boja vlastito svojstvo svjetlosti.
Newton je zapravo postavio temelje optičke spektroskopije: u "Optici" je opisao sva tri danas korištena načina razlaganja svjetlosti: lom, interferenciju i difrakciju, a njegova prizma s kolimatorom, prorezom i lećom bila je prvi spektroskop. Fragment Newtonove "Optike" rukopisa koji opisuje jedan od eksperimenata s prizmom.
Vrste spektara Spektri emisije Spektri apsorpcije Spektri raspršenja
Emisijski spektri Kontinuirana linija Prugasta
Kontinuirani spektar Daju tijela koja su u krutom, tekućem stanju, kao i guste plinove. Da biste ga dobili, morate zagrijati tijelo na visoku temperaturu. Priroda spektra ne ovisi samo o svojstvima pojedinačnih emitirajućih atoma, već i o međusobnom međudjelovanju atoma. Spektar sadrži sve valne duljine i nema prekida. Na difrakcijskoj rešetki može se promatrati kontinuirani spektar boja. Dobar prikaz spektra je prirodni fenomen duge. Isti su za različite tvari, pa se pomoću njih ne može odrediti sastav tvari
Linijski spektar Sastoji se od pojedinačnih linija različite ili iste boje, s različitim lokacijama Omogućuje procjenu kemijskog sastava izvora svjetlosti prema spektralnim linijama Daje sve tvari u plinovitom atomskom (ali ne i molekularnom) stanju (atomi praktički ne stupaju u interakciju s međusobno) Izolirani atomi određenog kemijskog elementa emitiraju valove strogo određene valne duljine.Za promatranje koriste sjaj para tvari u plamenu ili sjaj plinskog pražnjenja u cijevi ispunjenoj proučavanim plinom. Kad se gustoća atomskog plina povećava, pojedine spektralne linije se šire
Primjeri linijskih spektara
Prugasti spektar Dajte tvari koje su u molekularnom stanju. Spektar se sastoji od pojedinačnih traka odvojenih tamnim prazninama. Svaka traka je skup velikog broja vrlo blisko razmaknutih linija.Za promatranje se koristi sjaj para u plamenu ili sjaj plinskog izboja.
Primjeri prugastih spektara Spektar ugljičnog luka (trake molekula CN i C 2) Spektar emisije molekule joda.
Apsorpcijski spektar Ovo je ukupnost frekvencija koje apsorbira određena tvar. Tvar apsorbira one linije spektra koje emitira, kao izvor svjetlosti Spektri apsorpcije se dobivaju propuštanjem svjetlosti iz izvora koji daje kontinuirani spektar kroz tvar čiji su atomi u nepobuđenom stanju Ako se bijela svjetlost propusti kroz hladnu , plin koji ne emitira, tada će se na pozadini kontinuiranog izvora spektra pojaviti tamne linije. Plin najintenzivnije apsorbira svjetlost onih valnih duljina koju emitira u jako zagrijanom stanju. Tamne linije na pozadini kontinuiranog spektra su apsorpcijske linije koje zajedno tvore apsorpcijski spektar.
Primjeri apsorpcijskih spektara Fraunhofer Josef (1787. – 1826.) bio je njemački fizičar. Poboljšana proizvodnja leća, difrakcijskih rešetki. Detaljno opisao (1814) apsorpcijske linije u spektru Sunca, nazvane po njemu. Izumio heliometar-refraktor. Fraunhofer se s pravom smatra ocem astrofizike zbog svog rada u astronomiji. Fraunhoferove linije
Apsorpcijske linije u spektru zvijezda
Spektralna analiza Spektralna analiza je metoda za određivanje kemijskog sastava tvari prema njezinom spektru. Godine 1854. G. R. Kirchhoff i R. W. Bunsen počeli su proučavati spektre plamena obojenog parama metalnih soli, i kao rezultat toga postavili su temelje spektralne analize, prve instrumentalne spektralne metode - jedne od najmoćnijih metoda eksperimentalne znanosti.
Spektralna analiza je konačno razvijena 1859. Zapravo, spektralna analiza otvorila je novu eru u razvoju znanosti - proučavanje spektara kao vidljivih skupova vrijednosti funkcije stanja objekta ili sustava pokazalo se izuzetno plodnim i, u konačnici, dovelo do pojave kvantna mehanika: Planck je došao na ideju kvanta u procesu rada na teoriji tijela apsolutno crnog spektra.
Uz pomoć spektralne analize moguće je detektirati ovaj element u sastavu složene tvari, čak i ako njegova masa ne prelazi 10 -10 kg. Trenutno su određeni spektri svih atoma i sastavljene su tablice spektara. Uz pomoć spektralne analize otkriveni su mnogi novi elementi: rubidij, cezij itd. Pomoću spektralne analize saznao se kemijski sastav Sunca i zvijezda. Zbog svoje komparativne jednostavnosti i svestranosti, spektralna analiza je glavna metoda za praćenje sastava tvari u metalurgiji, strojarstvu i nuklearnoj industriji. Uz pomoć spektralne analize utvrđuje se kemijski sastav ruda i minerala. Sastav složenih, uglavnom organskih, smjesa analizira se njihovim molekulskim spektrima. Spektralna analiza može se provesti ne samo iz emisijskih, već i iz apsorpcijskih spektara. Upravo apsorpcijske linije u spektru Sunca i zvijezda omogućuju proučavanje kemijskog sastava ovih nebeskih tijela.
Spektralni aparati Spektralni aparati koriste se za precizno proučavanje spektra. Najčešće je glavni dio spektralnog aparata prizma ili difrakcijska rešetka. Za dobivanje spektra zračenja vidljivog područja koristi se uređaj nazvan spektroskop, u kojem ljudsko oko služi kao detektor zračenja. Spektroskop Spektrograf
Kirchhoff-Bunsenov spektroskop
- Deadpool - Rješavanje problema
- Ne počinje Kako preživjeti?
- Što učiniti ako se bioshock infinite ne pokreće
- Prolazak Nancy Drew: Alibi u pepelu
- Spec Ops: The Line - pregled igre, pregled Spec ops the line ruši se na misijama
- Uputstvo za bijeg iz sobe 1. razine
- Obrada rajčice s borne kiseline Koliko će 2 grama borne kiseline
- Trava od krastavca (borago)
- Bioinsekticid Lepidocid: namjena, svojstva i postupak primjene Karenca lepidocida
- Kako promijeniti jezik na ruski u Steamu
- Dendrobium noble: njega sobe
- Morfologija biljaka opći pojmovi - dokument
- Sadnja, razmnožavanje i njega bambusa kod kuće, fotografija Uzgoj bambusa iz sjemena
- Kako ojačati mobilni signal za internet u zemlji
- Sanskrt otkriva zaboravljeno značenje ruskih riječi (2 fotografije)
- Najstariji jezik sanskrt programski jezik budućnosti Mrtvi jezik sanskrt
- Tko ima vlast nad svom zemljom?
- Simboli i amuleti masona Poznati masonski amulet za novac
- Hekatin otac. Mračne božice. Podrijetlo i genealogija
- nord wind airline flota